Содержание
- 2. СОДЕРЖАНИЕ: Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические свойства.Специфические Таблица
- 3. Одна связь с кислородом образуется по донорно-акцепторному механизму, но из-за близости расположения атомов в молекуле становятся
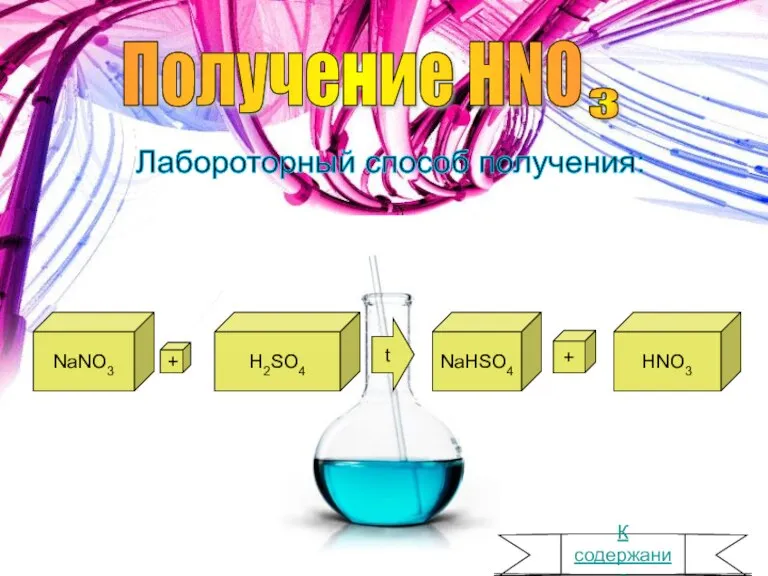
- 4. Получение HNO 3 Лабороторный способ получения: NaNO3 + H2SO4 t NaHSO4 + HNO3 К содержанию
- 5. 1) 4NH3 + 5O2 -> 4NO + 6H2O + Q 2) 2 NO + O2 ->
- 6. Физические свойства бесцветная жидкость летучая – на воздухе « дымит» неограниченно смешивается с водой tпл=-41,60C tкип=82,60C
- 7. Химические свойства Общие с другими кислотами: 1.Сильный электролит, хорошо диссоциируют на ионы. HNO3 -> H+ +NO3-
- 8. Химические свойства Специфические: 5. при нагревании и под действием света разлагается. 4HNO3 -> 2H2O +4NO2 +
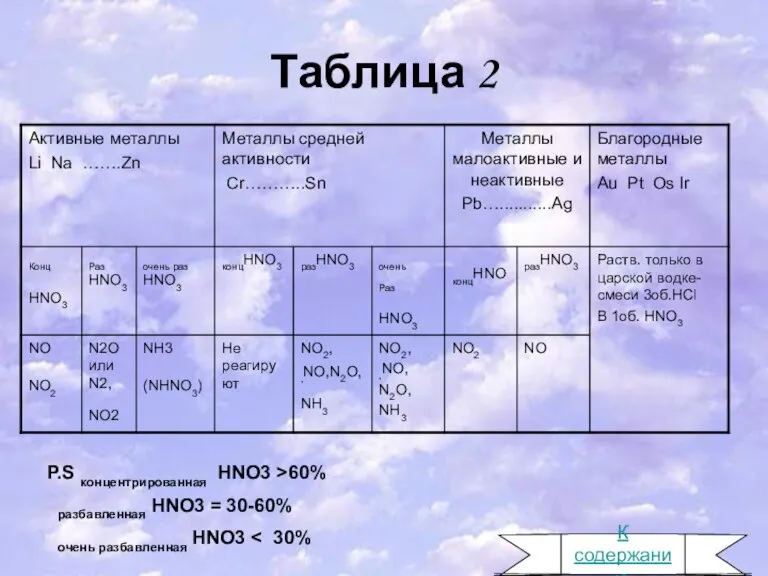
- 9. Таблица 2 P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 К содержанию
- 10. Азотная кислота широко используется для производства азотных удобрений, искусственных волокон, органических красителей, лаков и взрывчатых веществ.
- 12. Скачать презентацию







 Зодчество Галицкой земли 12 века
Зодчество Галицкой земли 12 века Внешняя политика России
Внешняя политика России Прощание с Букварем
Прощание с Букварем Презентация на тему Реформация и Контрреформация в Европе
Презентация на тему Реформация и Контрреформация в Европе  Ася. Иван Тургенев
Ася. Иван Тургенев Диаграммы и графики.
Диаграммы и графики. © Министерство информатизации и связи Красноярского края 2012 г. Вебинар для сотрудников ОМСУ Красноярского края: - Готовность Реест
© Министерство информатизации и связи Красноярского края 2012 г. Вебинар для сотрудников ОМСУ Красноярского края: - Готовность Реест Языческие праздники на Руси
Языческие праздники на Руси Fandrayzing
Fandrayzing Г. А. Цукерман, К. Н. Поливанова
Г. А. Цукерман, К. Н. Поливанова Генетический анализ вместо химиотерапии
Генетический анализ вместо химиотерапии Презентация на тему Театр в XVIII веке в России
Презентация на тему Театр в XVIII веке в России  Инженерная компьютерная графика
Инженерная компьютерная графика Акробатические элементы
Акробатические элементы Презентация_МР_Чистодей
Презентация_МР_Чистодей РЕАБИЛИТАЦИЯ СЕГОДНЯ и ЗАВТРА Докладчик: Булекбаева Ш.А., Председатель Правления АО РДРЦ, дмн, внештатный медицинский реабилитолог
РЕАБИЛИТАЦИЯ СЕГОДНЯ и ЗАВТРА Докладчик: Булекбаева Ш.А., Председатель Правления АО РДРЦ, дмн, внештатный медицинский реабилитолог Обратная пропорциональность
Обратная пропорциональность Уважаеми работодатели,
Уважаеми работодатели, Генограмма семьи
Генограмма семьи Polish language
Polish language Gobozov
Gobozov Презентация "Азбука Архитектуры" - скачать презентации по МХК
Презентация "Азбука Архитектуры" - скачать презентации по МХК Основные положения закона Российской Федерации в области физической культуры, спорта, туризма, охраны здоровья
Основные положения закона Российской Федерации в области физической культуры, спорта, туризма, охраны здоровья Роза
Роза Деловая графика MS Exel
Деловая графика MS Exel Білезік фото
Білезік фото 4
4 Методическая разработка мастер-класса
Методическая разработка мастер-класса