Слайд 2Содержание
Определение
Функции белков
Источники аминокислот
Строение полипептидной цепи
Структура белка
Химические свойства
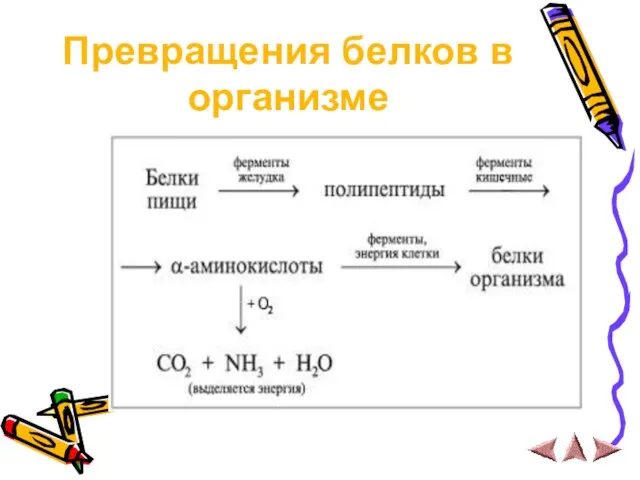
Превращения белков в организме
Источники информации

Слайд 3Определение
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков α-

аминокислот, соединенных между собой пептидными связями.
Слайд 4Функции белков
1) Структурная (пластическая) – белками образованы многие клеточные компоненты, а в комплексе

с липидами они входят в состав клеточных мембран.
2) Каталитическая – все биологические катализаторы – ферменты по своей химической природе являются белками.
Слайд 53) Транспортная – белок гемоглобин транспортирует кислород, ряд других белков образуя комплекс

с липидами транспортируют их по крови и лимфе (пример: миоглобин, сывороточный альбумин).
4) Механохимическая – мышечная работа и иные формы движения в организме осуществляются при непосредственном участии сократительных белков с использованием энергии макроэргических связей (пример:
актин, миозин).
Слайд 65) Регуляторная – ряд гормонов и других биологически активных веществ имеют белковую природу

(пр.: инсулин, АКТГ).
6) Защитная – антитела (иммуноглобулины) являются белками, кроме того основу кожи составляет белок коллаген, а волос – креатин. Кожа и волосы защищают внутреннюю среду организма от внешних воздействий. В состав слизи и синовиальной жидкости входят
мукопротеиды.
Слайд 77) Опорная – сухожилия, поверхности суставов соединения костей
образованы в значительной

степени белковыми веществами (пр.: коллаген, эластин).
8) Энергетическая – аминокислоты белков могут поступать на путь гликолиза, который обеспечивает клетку энергией.
9) Рецепторная – многие белки
участвуют в процесса избирательного
узнавания(рецепторы).
Слайд 8Источники аминокислот
Основным источником α- аминокислот для живого организма служат пищевые белки, которые

в результате ферментативного гидролиза в желудочно-кишечном тракте дают α - аминокислоты. Многие α - аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α - аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми.
К ним относятся:
валин, лейцин, треонин, метионин, триптофан и т.д.
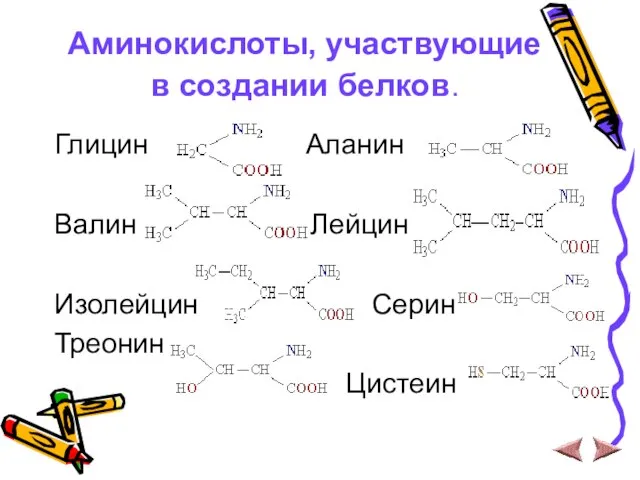
Слайд 9Аминокислоты, участвующие в создании белков.
Глицин Аланин
Валин Лейцин
Изолейцин Серин
Треонин
Цистеин
Слайд 10МЕТИОНИН
ЛИЗИН
АРГИНИН
АСПАРАГИН
АСПАРАГИНОВАЯ
КИСЛОТА
ГЛУТАМИНОВАЯ
КИСЛОТА

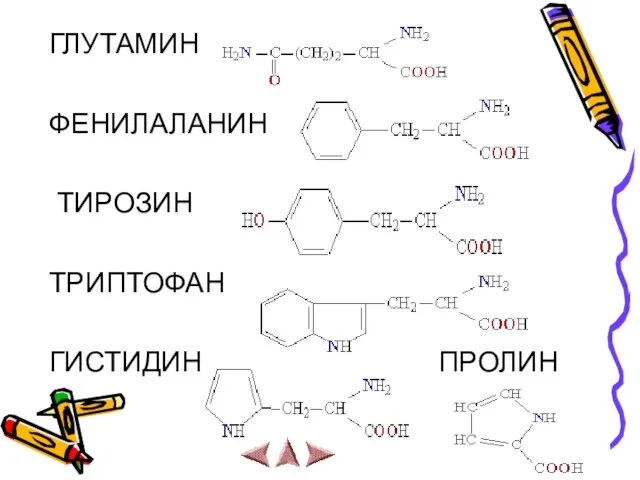
Слайд 11ГЛУТАМИН
ФЕНИЛАЛАНИН
ТИРОЗИН
ТРИПТОФАН
ГИСТИДИН ПРОЛИН
Слайд 12Строение полипептидной цепи
Эта цепь имеет неразветвленное строение и состоит из чередующихся метиновых

(CH) и пептидных (CONH) групп. Различия такой цепи заключаются в боковых радикалах, связанных с метиновой группой, и характеризующих ту или иную аминокислоту.
Слайд 13Последовательное
соединение аминокислот
при образовании белковой
молекулы. В качестве
основного направления
полимерной цепи выбран
путь от
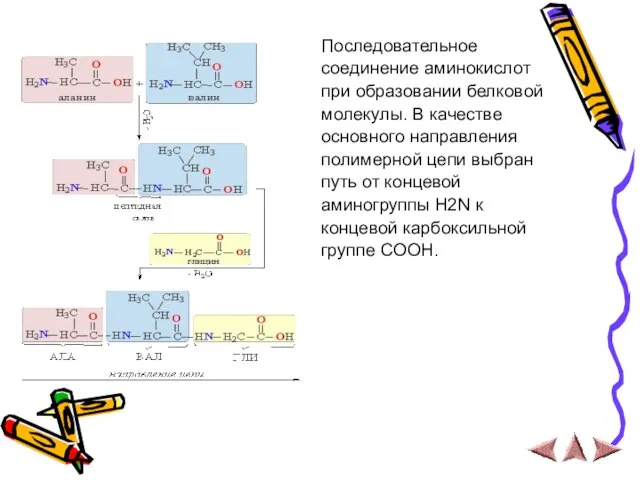
концевой
аминогруппы H2N к
концевой карбоксильной
группе COOH.
Слайд 14Структура белка
Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования α-
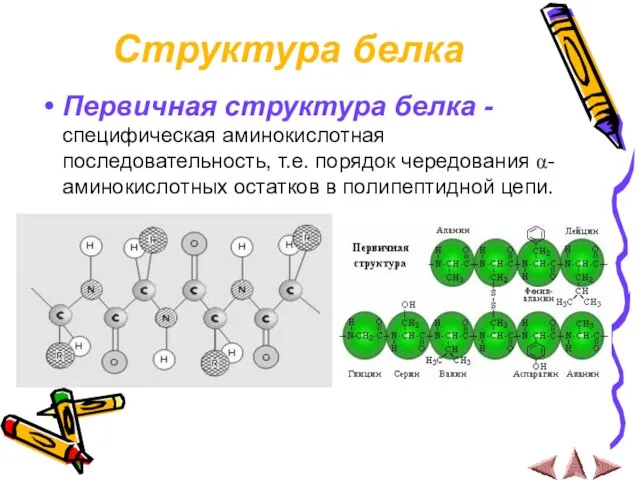
аминокислотных остатков в полипептидной цепи.
Слайд 15Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в
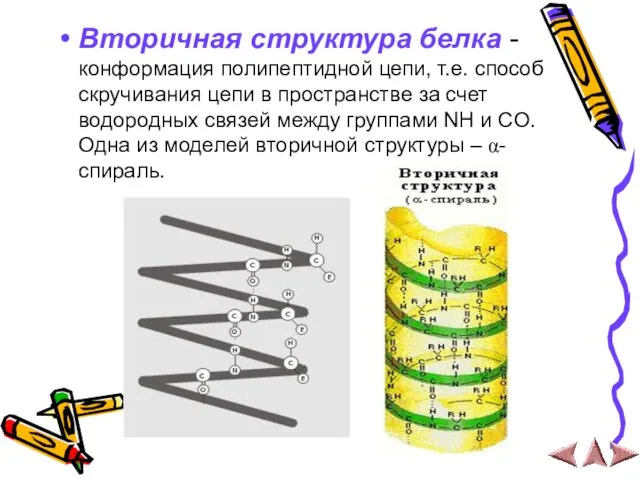
пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры – α- спираль.
Слайд 16Третичная структура белка - форма закрученной спирали в пространстве, образованная главным образом

за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий.
Слайд 17Четвертичная структура белка – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за

счет взаимодействия разных
полипептидных цепей
Слайд 18Химические свойства
1) Амфотерность связана с наличием в молекуле белка катионообразующих групп

– аминогрупп и анионообразующих – карбоксильных группу. Знак заряда молекулы зависит от количества свободных групп. Если преобладают карбоксильные группы то заряд молекулы отрицательный (проявляются свойства слабой кислоты), если аминогруппы – то положительный (основные свойства).
Слайд 19 2) Денатурация. Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической

функции, называется денатурацией. С точки зрения структуры белка – это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т.д.
Слайд 20 При действии органических растворителей, продуктов жизнедеятельности некоторых бактерий (молочнокислое брожение) или

при повышении температуры происходит разрушение вторичных и третичных структур без повреждения его первичной структуры, в результате белок теряет растворимость и утрачивает биологическую активность.
Слайд 21 Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая,

ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина при варке яиц.
Слайд 223) Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей

или ферментов, приводящее к образованию a- аминокислот, из которых он был составлен.
Слайд 234) Качественные реакции на белки:
a) Биуретовая реакция – фиолетовое окрашивание при действии

солей меди (II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.
Слайд 24б) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты

на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).
Слайд 26 Белки в живом организме постоянно расщепляются на исходные аминокислоты (с непременным

участием ферментов), одни аминокислоты переходят в другие, затем белки вновь синтезируются (также с участием ферментов), т.е. организм постоянно обновляется. Некоторые белки (коллаген кожи, волос) не обновляются, организм непрерывно их теряет и взамен синтезирует новые. Белки как источники питания выполняют две основные функции: они поставляют в организм строительный материал для синтеза новых белковых молекул и, кроме того, снабжают организм энергией (источники калорий).
Слайд 27Источники информации
1.http://www.kirensky.ru/books/book/Biochemistry/chapter_02.htm
2.http://www.krugosvet.ru/articles/118/1011840/print.htm
3.http://www.ximicat.com/info.php?id=8
4. http://rrc.dgu.ru/res/1september/22-10.htm

Слайд 285.http://www.chemistry.ssu.samara.ru/chem6/hm63.htm
6. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. Учебник для вузов./

Под ред. Петрова А.А. – М.: Высшая школа,1981.
7. Хомченко Г.П. Пособие по химии для поступающих в вузы. – М.: ООO «Издательство Новая Волна», 2002.
8. Потапов В.М., Чертков И.Н. Строение и свойства органических веществ. Пособие для учащихся 10 кл. – М.: Просвещение, 1980.


























 «Мастер и Маргарита»В. Лакшин отмечал, что, «выбирая посмертную судьбу Мастеру, Булгаков выбирал судьбу себе». Это его изм
«Мастер и Маргарита»В. Лакшин отмечал, что, «выбирая посмертную судьбу Мастеру, Булгаков выбирал судьбу себе». Это его изм Я выбираю здоровый образ жизни
Я выбираю здоровый образ жизни Информация вокруг нас
Информация вокруг нас Взаимное расположение графиков линейных функций
Взаимное расположение графиков линейных функций Все люди любят праздники
Все люди любят праздники Wether
Wether Тема: «Тайны древних пирамид» Маркова Марина Валерьевна 2009 – 2010 учебный год
Тема: «Тайны древних пирамид» Маркова Марина Валерьевна 2009 – 2010 учебный год Прохождение производственной практики в Департаменте образования и науки Брянской области
Прохождение производственной практики в Департаменте образования и науки Брянской области Нейропсихологический аспект в речевой и познавательной деятельности
Нейропсихологический аспект в речевой и познавательной деятельности Русский Иерусалим Патриарха Никона
Русский Иерусалим Патриарха Никона Путешествие в Древнюю Индию
Путешествие в Древнюю Индию Как правильно презентовать стартап
Как правильно презентовать стартап Организация финансирования инвестиционной деятельности
Организация финансирования инвестиционной деятельности Книги про Новый год и Рождество
Книги про Новый год и Рождество Деловая игра Слалом
Деловая игра Слалом Различные способы решения квадратных уравнений
Различные способы решения квадратных уравнений Текст и его признаки
Текст и его признаки Управление проектамиЛекция 2.Структурное планирование
Управление проектамиЛекция 2.Структурное планирование Буклет ВМПИ
Буклет ВМПИ Команда Приморские Медведи
Команда Приморские Медведи Число-буквенный код. Техника запоминания картин
Число-буквенный код. Техника запоминания картин Кухар-кондитер
Кухар-кондитер  Система школьного мониторинга в управлении качеством образования
Система школьного мониторинга в управлении качеством образования Проект Evrikum. Стеклянный лабиринт
Проект Evrikum. Стеклянный лабиринт Реализация PR и IR стратегий: особенности национального информационного поля
Реализация PR и IR стратегий: особенности национального информационного поля КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ Правомерно ли Выделять категорию состояния, Как самостоятельную часть речи?
Правомерно ли Выделять категорию состояния, Как самостоятельную часть речи? Государственное учреждение образования Новосёлковский ясли – сад Пуховичского района
Государственное учреждение образования Новосёлковский ясли – сад Пуховичского района