Содержание
- 2. КЛАССИФИКАЦИЯ РЕАКЦИЙ Неокислительно-восстановительные реакции Ag +1Cl -1+Na +12S -2 = Ag +12S -2+Na +1Cl-1 Окислительно-восстановительные реакции
- 3. Окислительно-восстановительные реакции – реакции, протекающие с изменением степеней окисления атомов всех или некоторых элементов, входящих в
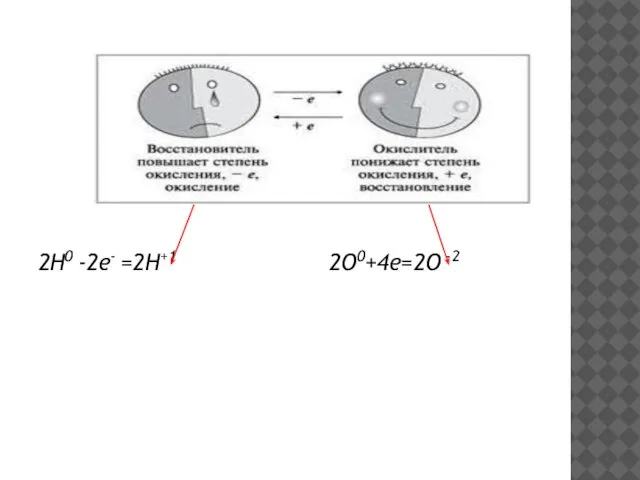
- 4. ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ Окисление -процесс отдачи электронов атомов, молекулой или ионом. H 02 +O 02=H +12O-2
- 5. Процесс присоединения электронов атомом, ионом или молекулой называют восстановлением. H 02 +O 02=H +12O-2 2О0 +4е-
- 6. 2Н0 -2е- =2Н+1 2О0+4е=2О -2
- 7. Различают: минимальную (низшую) степень окисления S-2 2e- 8e- 8e- промежуточную степень окисления S0 2e- 8e- 6e-
- 8. ВОССТАНОВИТЕЛИ Простые вещества металлы могут быть только восстановителями. В периодах с возрастанием атомного номера восстановительные свойства
- 9. ОКИСЛИТЕЛИ Простые вещества являющиеся только окислителями – это фтор и кислород (кроме реакции со фтором). В
- 10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ ДВОЙСТВЕННОСТЬ Вещества, содержащие в составе атомы элементов в промежуточной степени окисления, способны проявлять как окислительные,
- 11. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОВР Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo испoльзуют метод электронного баланса и метод
- 12. 1. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции: FeCl3 + H2S → FeCl2 + S +
- 13. 3. Cocтавим электронные урaвнeния, вырaжaющиe прoцeccы oкиcлeния и вoccтанoвлeния. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов,
- 14. 5. Подберем стехиометрические коэффициенты ocтaльныxучacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства вместо
- 16. Скачать презентацию












 Презентация на тему Восточная Сибирь
Презентация на тему Восточная Сибирь  Упрощение выражений
Упрощение выражений Проект «Аналогия» был запущен нами более десяти лет назад и возник как плод сочетания потенциалов юриста и бухгалтера с целью реше
Проект «Аналогия» был запущен нами более десяти лет назад и возник как плод сочетания потенциалов юриста и бухгалтера с целью реше Генеалогия
Генеалогия Колизей в Риме
Колизей в Риме 1С-Битрикс: Корпоративный портал
1С-Битрикс: Корпоративный портал Слова антонимы (Противоположности)
Слова антонимы (Противоположности) Cisco Solution Technology Integrator Сетевая безопасность для вертикальных рынков Решения для коммуникационных провайдеров СТАНДАРТ СЕТЕВОЙ БЕЗО
Cisco Solution Technology Integrator Сетевая безопасность для вертикальных рынков Решения для коммуникационных провайдеров СТАНДАРТ СЕТЕВОЙ БЕЗО Китайский новый год
Китайский новый год 20 причин любить Рёму
20 причин любить Рёму Путь. Перемещение. Определение координаты движущегося тела
Путь. Перемещение. Определение координаты движущегося тела Pancakes day
Pancakes day Критерии и методика отнесения документов к категории для служебного пользования
Критерии и методика отнесения документов к категории для служебного пользования Учебные видеоролики, как ресурс саморазвития
Учебные видеоролики, как ресурс саморазвития Система Box-Design & Nevo
Система Box-Design & Nevo Рекомендуемые подходы определения страховых резервов по договорам страхования жизни На основе Проекта Минфина Правил формирова
Рекомендуемые подходы определения страховых резервов по договорам страхования жизни На основе Проекта Минфина Правил формирова Дома гороскопа
Дома гороскопа Сложение и вычитание десятичных дробей.
Сложение и вычитание десятичных дробей. Судьба старославянизмов в русском языке
Судьба старославянизмов в русском языке Подготовка к написанию изложения по рассказу Л.Н.Толстого «Акула»
Подготовка к написанию изложения по рассказу Л.Н.Толстого «Акула» Обобщающий урок по теме:
Обобщающий урок по теме: Маркетинговые исследования
Маркетинговые исследования  Факторы развития когнитивных способностей в процессе обучения
Факторы развития когнитивных способностей в процессе обучения Доступ к данным на основе ado
Доступ к данным на основе ado Весна. Детские рисунки
Весна. Детские рисунки Декларация на товары
Декларация на товары Химическое действие света. Фотография
Химическое действие света. Фотография Моделирование, как метод познания (10 класс)
Моделирование, как метод познания (10 класс)