Содержание
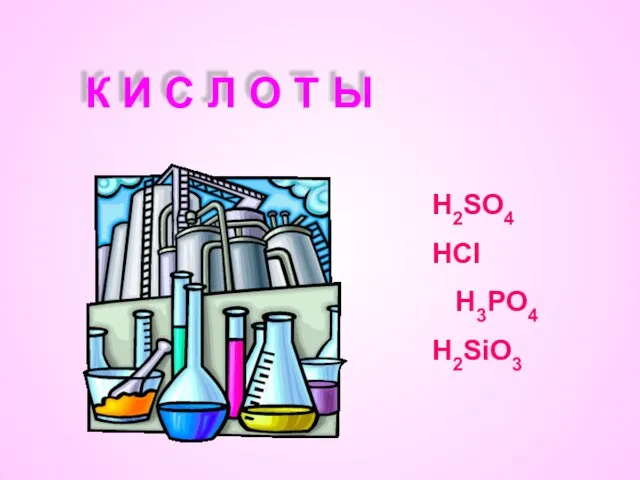
- 2. К И С Л О Т Ы Н2SO4 HCl H3PO4 H2SiO3
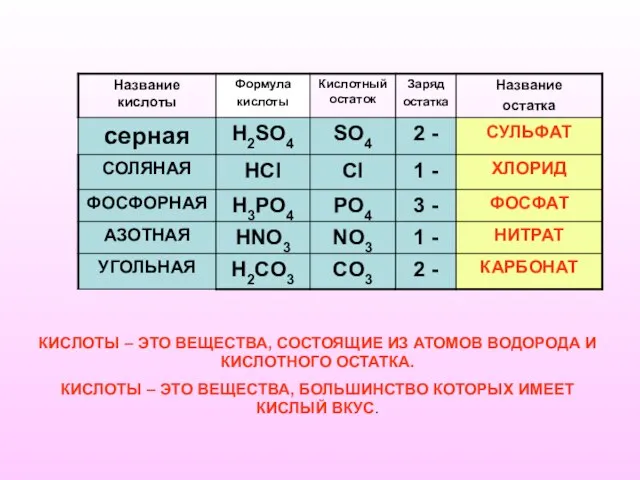
- 3. КИСЛОТЫ – ЭТО ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ АТОМОВ ВОДОРОДА И КИСЛОТНОГО ОСТАТКА. КИСЛОТЫ – ЭТО ВЕЩЕСТВА, БОЛЬШИНСТВО
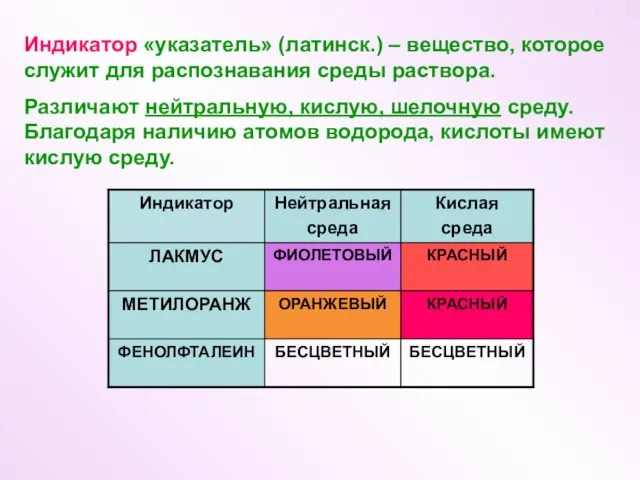
- 4. Индикатор «указатель» (латинск.) – вещество, которое служит для распознавания среды раствора. Различают нейтральную, кислую, шелочную среду.
- 5. ПРАВИЛА, КОТОРЫЕ НАДО СОБЛЮДАТЬ ПРИ РАСТВОРЕНИИ КИСЛОТ. Налей в стакан воду. Тонкой струйкой влей в нее
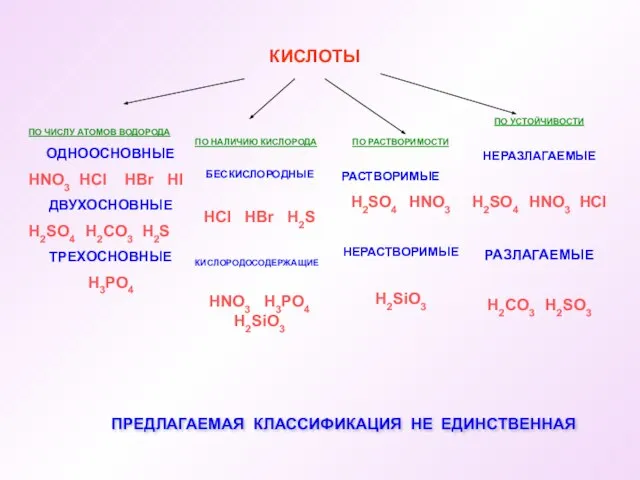
- 6. КИСЛОТЫ ПО ЧИСЛУ АТОМОВ ВОДОРОДА ОДНООСНОВНЫЕ HNO3 HCl HBr HI ДВУХОСНОВНЫЕ H2SO4 H2CO3 H2S ТРЕХОСНОВНЫЕ H3PO4
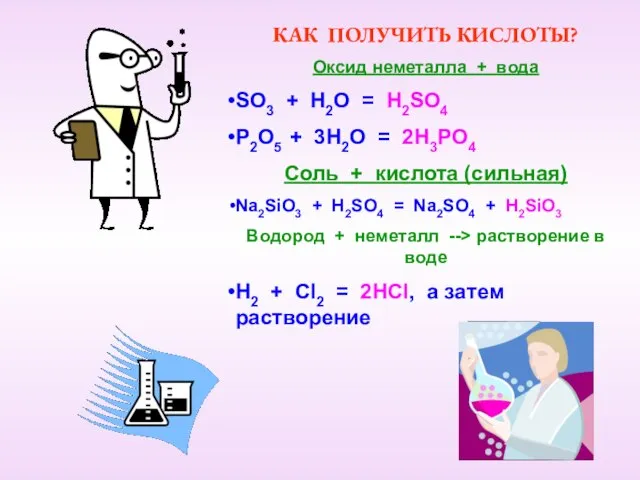
- 7. КАК ПОЛУЧИТЬ КИСЛОТЫ? Оксид неметалла + вода SO3 + H2O = H2SO4 P2O5 + 3H2O =
- 8. СВОЙСТВА ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ: 2HCl + Fe = FeCl2 + H2 Атомы металлов окисляются, а ионы
- 9. ПОЗНАКОМИМСЯ С ВАЖНЕЙШИМИ ИЗ КИСЛОТ … КАКИЕ ЭТО КИСЛОТЫ? ЧТО ТЫ О НИХ ЗНАЕШЬ?
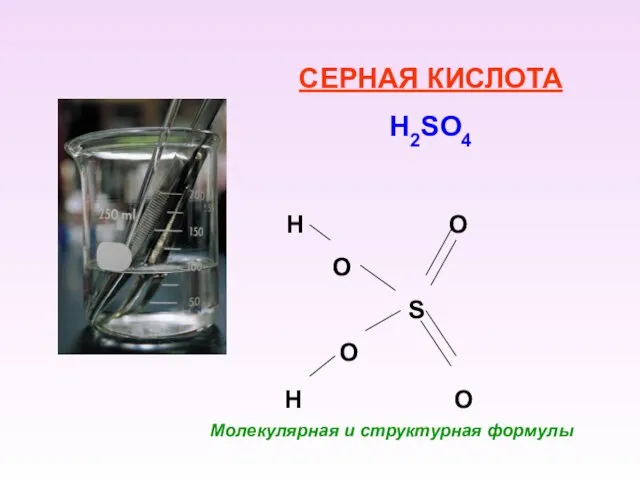
- 10. СЕРНАЯ КИСЛОТА H2SO4 H O O S O H O Молекулярная и структурная формулы
- 11. Серная кислота – тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты,
- 12. ПРИМЕНЕНИЕ СЕРНОЙ КИСЛОТЫ H2SO4
- 13. АЗОТНАЯ КИСЛОТА. ФОРМУЛА - HNO3 O СТРУКТУРНАЯ ФОРМУЛА - H O N O Азотная кислота –
- 14. Азотная кислота проявляет все типичные свойства кислот, но вот с металлами она ведет себя по –
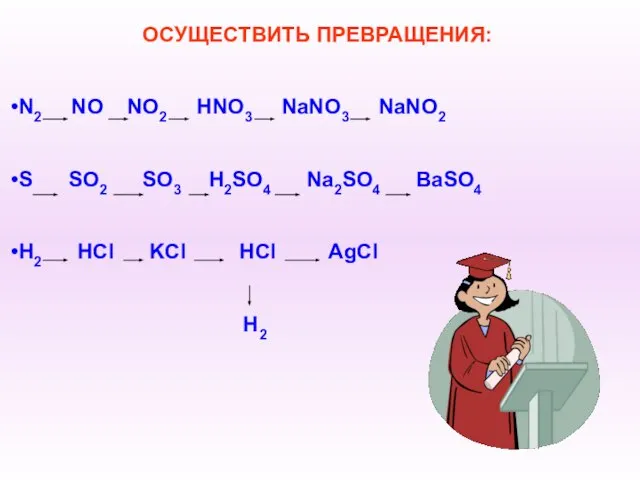
- 15. ОСУЩЕСТВИТЬ ПРЕВРАЩЕНИЯ: N2 NO NO2 HNO3 NaNO3 NaNO2 S SO2 SO3 H2SO4 Na2SO4 BaSO4 H2 HCl
- 17. Скачать презентацию







 Взаимосвязь метапредметных и предметных результатов обучения в начальной школе
Взаимосвязь метапредметных и предметных результатов обучения в начальной школе Эталонная модель RM OSI: данные, функции
Эталонная модель RM OSI: данные, функции Ecological and economic problems of management of lan resourses
Ecological and economic problems of management of lan resourses  Николай Рубцов
Николай Рубцов Презентация на тему Адресация в сети интернет
Презентация на тему Адресация в сети интернет ДЕТСТВО, ОПАЛЕННОЕ ВОЙНОЙ
ДЕТСТВО, ОПАЛЕННОЕ ВОЙНОЙ Презентация на тему Состав, структура и соотношения цен
Презентация на тему Состав, структура и соотношения цен  урок 31 Степенные функции их свойства и графики
урок 31 Степенные функции их свойства и графики Маньяки… кто есть кто
Маньяки… кто есть кто Бенчмаркинг. Производство фанеры за январь-май 2018 года
Бенчмаркинг. Производство фанеры за январь-май 2018 года Внеклассное мероприятие День птиц «Птичьи трели»
Внеклассное мероприятие День птиц «Птичьи трели» Петербургский метрополитен. История, факты, схема
Петербургский метрополитен. История, факты, схема Накануне 50-летия нашего города я решил найти фотографии его строительства. Зачастую местность так меняется, что, сопоставив две фо
Накануне 50-летия нашего города я решил найти фотографии его строительства. Зачастую местность так меняется, что, сопоставив две фо Жизнь животных зимой
Жизнь животных зимой Система бухгалтерской отчетности
Система бухгалтерской отчетности Метод скользящего контроля для оценки качества рекомендательных интернет-сервисов
Метод скользящего контроля для оценки качества рекомендательных интернет-сервисов Выбор компании разработчика
Выбор компании разработчика N_F_Andreychenko_Osvoenie_intellektualnykh_funktsiy
N_F_Andreychenko_Osvoenie_intellektualnykh_funktsiy Должностная инструкция учителя
Должностная инструкция учителя ЭКОНОМИКА ЗДРАВООХРАНЕНИЯ
ЭКОНОМИКА ЗДРАВООХРАНЕНИЯ  Что такое налоги зачем их платить? Кружок Основы финансовой грамотности 8, 9 класс
Что такое налоги зачем их платить? Кружок Основы финансовой грамотности 8, 9 класс Презентация на тему строение клетки
Презентация на тему строение клетки Компьютеры фирмы Apple
Компьютеры фирмы Apple Особенности социально-экономического развития ведущих стран глобальной экономики в 1870-1913
Особенности социально-экономического развития ведущих стран глобальной экономики в 1870-1913 Слово в общенациональном и юридическом языке. Соломоново решение. Над презентацией
Слово в общенациональном и юридическом языке. Соломоново решение. Над презентацией  Бизнес-план ОООCerberus
Бизнес-план ОООCerberus Презентация на тему Прошедшее время глагола в русском языке
Презентация на тему Прошедшее время глагола в русском языке  Дифференциальная диагностика и лечение поражений ЦНС у больных ВИЧ-инфекцией
Дифференциальная диагностика и лечение поражений ЦНС у больных ВИЧ-инфекцией