д.м.н., проф. М.К. Соболева Оценка качества препаратов для терапии гемофилии АПлазматические и рекомбинантные факторы свертывания
Содержание
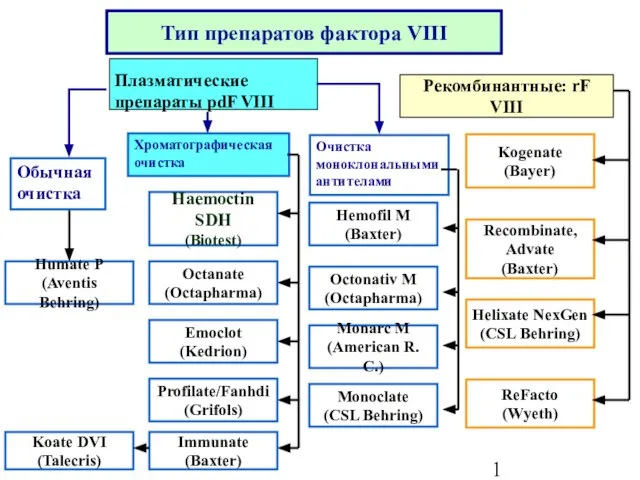
- 2. Тип препаратов фактора VIII Рекомбинантные: rF VIII
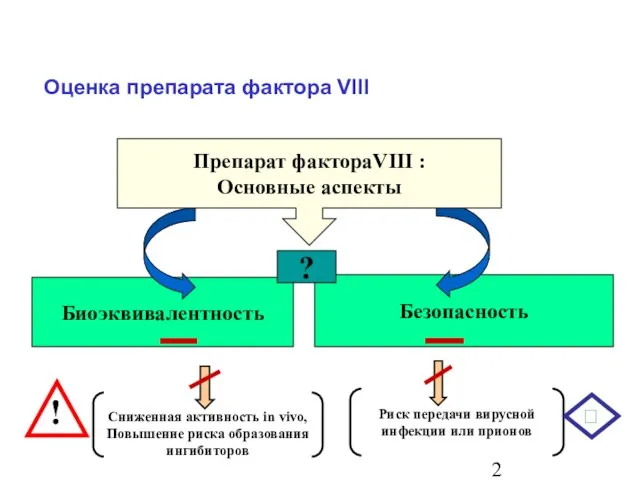
- 3. Оценка препарата фактора VIII
- 4. Рекомбинантные препараты FVIII: в течение 15 – летнего опыта клинического применения не было зарегистрировано ни одного
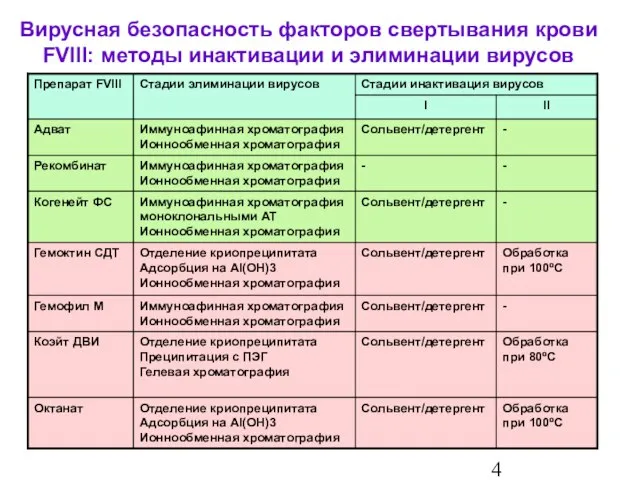
- 5. Обзор Вирусная безопасность факторов свертывания крови FVIII: методы инактивации и элиминации вирусов
- 6. Из письма Управления по контролю за лекарственными препаратами продуктами питания (FDA) США к производителям рекомбинантных факторов
- 7. Что с особо опасными вирусами ? Вирус лихорадки Западного Нила (WNV) ? SARS (коронавирус) ? Концепция
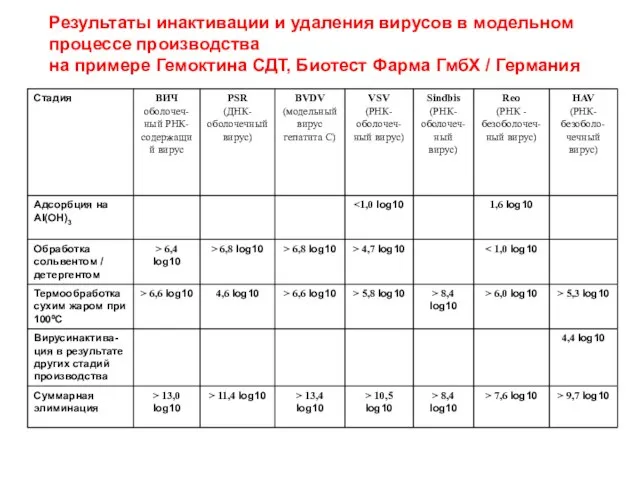
- 8. Результаты инактивации и удаления вирусов в модельном процессе производства на примере Гемоктина СДТ, Биотест Фарма ГмбХ
- 9. Что с особо опасными вирусами ? Вирус лихорадки Западного Нила (WNV) и SARS (коронавирус) эффективно и
- 10. Прионная безопасность плазматических и рекомбинантных факторов свертывания крови Прионы присутствуют в организме всех млекопитающих ! Клетки
- 11. Минимизация риска передачи вБКЯ через кровь, плазму и продукты плазмы Исключение всех материалов животного происхождения, которые
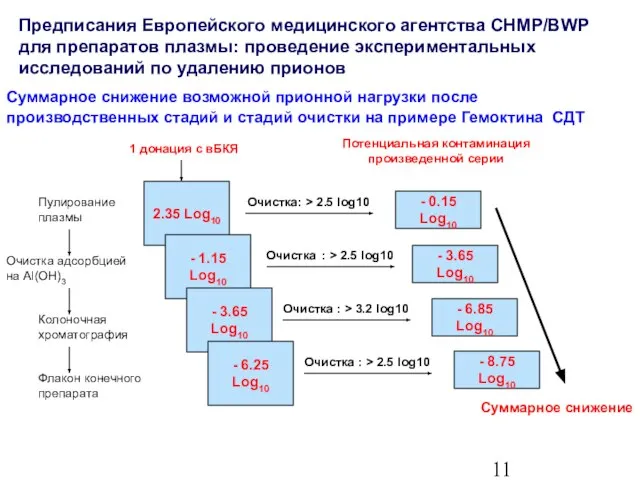
- 12. Суммарное снижение возможной прионной нагрузки после производственных стадий и стадий очистки на примере Гемоктина СДТ Пулирование
- 13. Прионная безопасность плазменных препаратов на примере Гемоктина СДТ Специфические стадии производства препарата 6.25 log10 Остальные стадии
- 14. Различие в структуре молекулы FVIII Плазматические FVIII содержат иммуномодулирующие пептиды (например, αTNF) Плазматические FVIII содержат VWF
- 15. Lin, Barrowcliffe et al. Univers. of Quebec, Canadian Blood Servics, Ontario and NIBSC, London “Relationships between
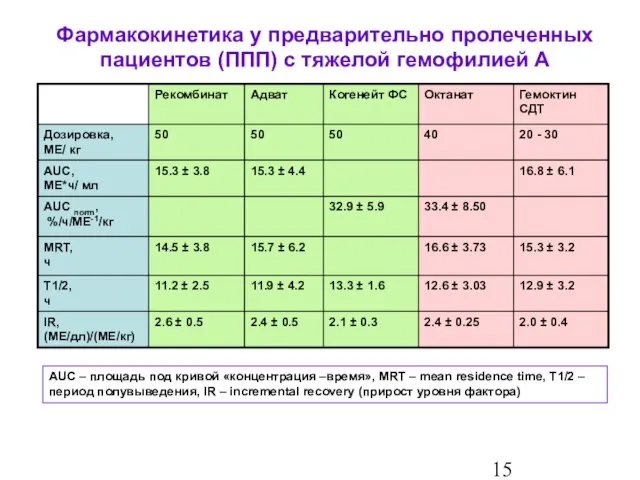
- 16. Фармакокинетика у предварительно пролеченных пациентов (ППП) с тяжелой гемофилией А AUC – площадь под кривой «концентрация
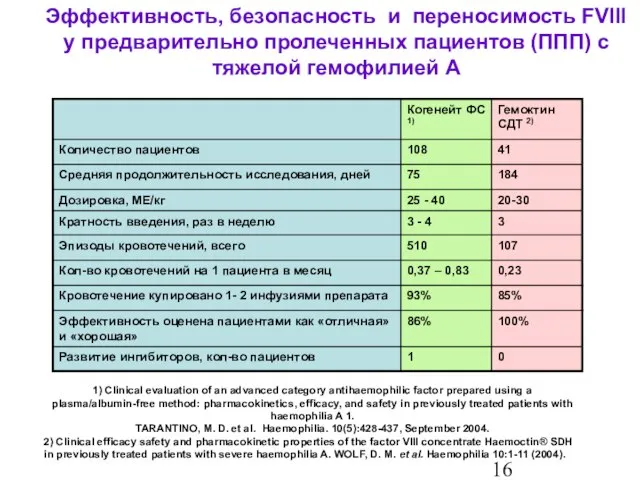
- 17. Эффективность, безопасность и переносимость FVIII у предварительно пролеченных пациентов (ППП) с тяжелой гемофилией А 1) Clinical
- 18. Риск развития ингибиторов Генетическая мутация фактора VIII Другие генетические факторы Раса и этническая принадлежность Семейный анамнез
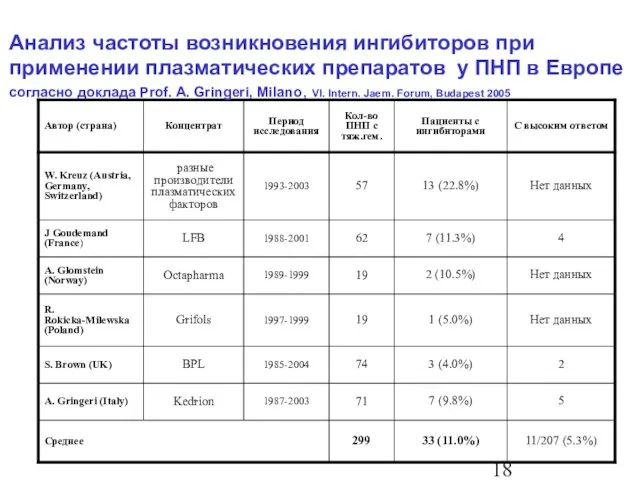
- 19. 11/207 (5.3%) 33 (11.0%) 299 Среднее 5 7 (9.8%) 71 1987-2003 Kedrion A. Gringeri (Italy) 2
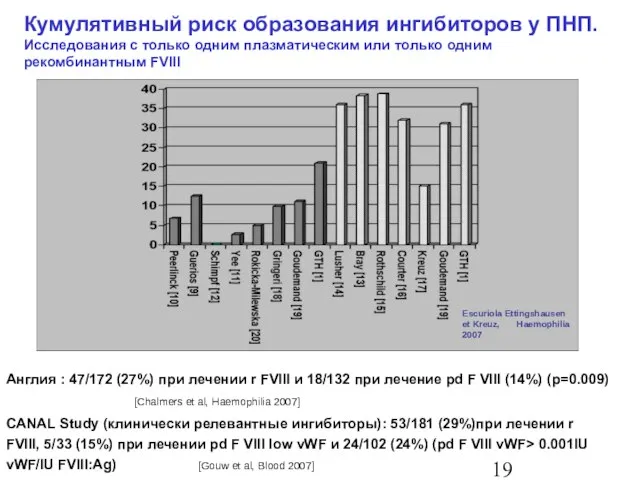
- 20. Кумулятивный риск образования ингибиторов у ПНП. Исследования с только одним плазматическим или только одним рекомбинантным FVIII
- 21. Негомогенные группы пациентов Тяжесть заболевания ( Тип мутации Этническая принадлежность Предварительное лечение (ПНП, мало леченные пациенты)
- 22. Влияние типа препарата (рекомбинантный или плазматический) на частоту образования ингибиторов к FVIII у предварительно нелеченных пациентов
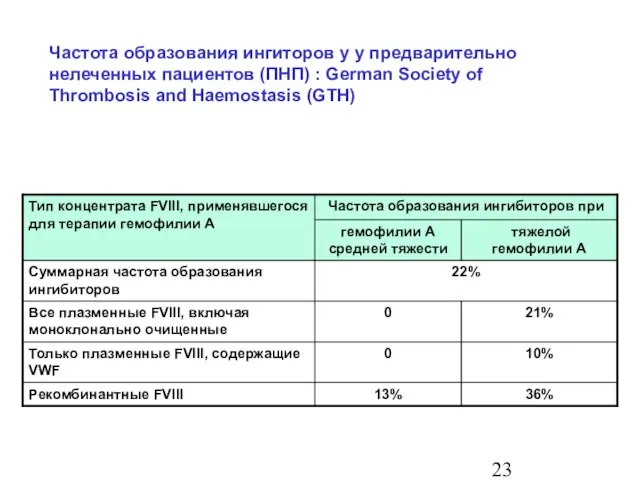
- 23. Частота образования ингибиторов у предварительно нелеченных пациентов (ПНП) : German Society of Thrombosis and Haemostasis (GTH)
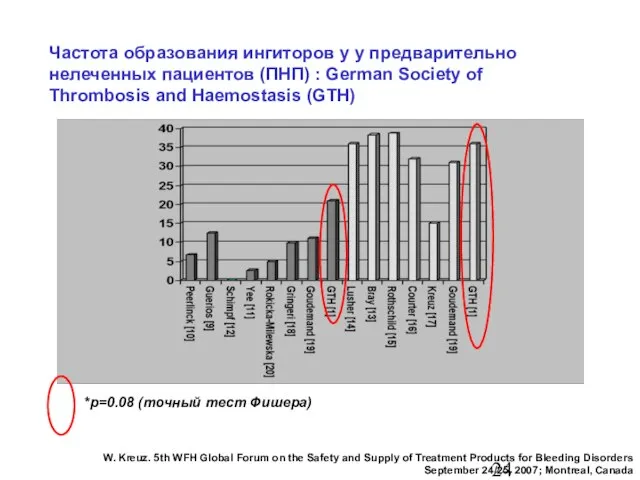
- 24. Частота образования ингиторов у у предварительно нелеченных пациентов (ПНП) : German Society of Thrombosis and Haemostasis
- 25. Частота образования ингиторов у у предварительно нелеченных пациентов (ПНП) : German Society of Thrombosis and Haemostasis
- 26. Ингибиторы у предварительно пролеченных пациентов (ППП): отчеты производителей в Федеральное ведомство по вакцинам и сывороткам Германии
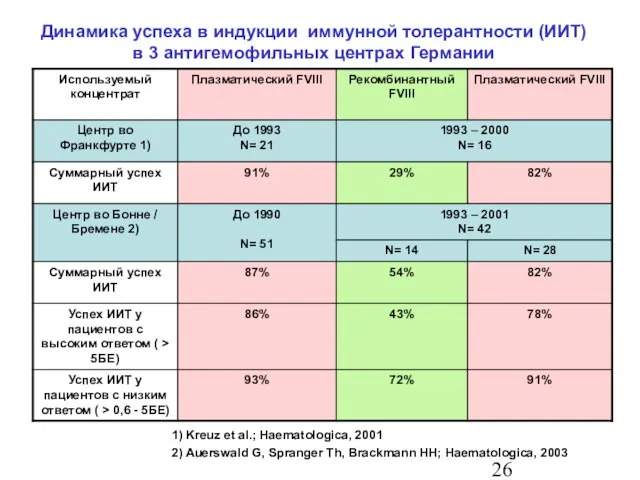
- 27. 1) Kreuz et al.; Haematologica, 2001 2) Auerswald G, Spranger Th, Brackmann HH; Haematologica, 2003 Динамика
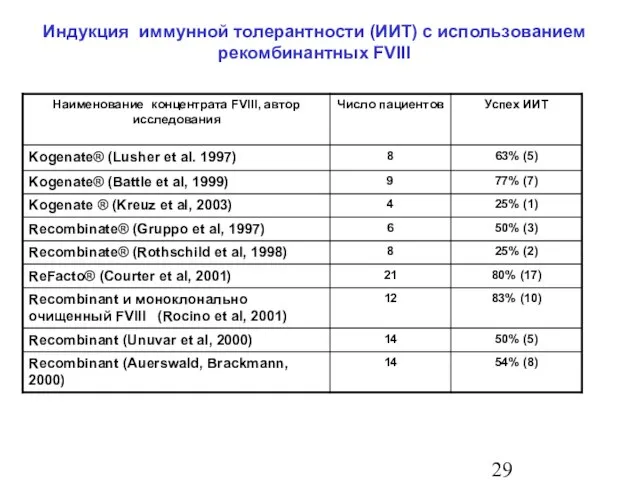
- 28. Эффективность ИИТ с использованием рFVIII Successfull ITI with Haemoctin® SDH C. Biedlingmeier, Poster: Haemophilia Symposium, Seefeld
- 29. C.Escuriola Ettingshausen, W. Kreuz Johann-Wolfgang-Goethe University Hospital Dept. Of Pediatrics III Hematology, Oncology and Hemostaseology, Germany
- 30. Индукция иммунной толерантности (ИИТ) с использованием рекомбинантных FVIII
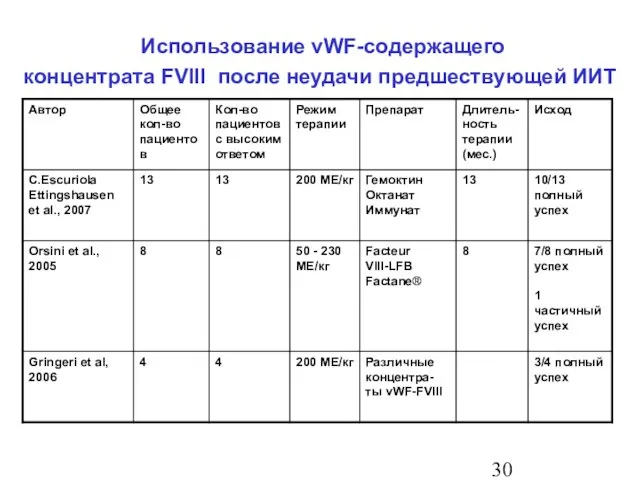
- 31. Использование vWF-содержащего концентрата FVIII после неудачи предшествующей ИИТ
- 32. Замена во время ИИТ rFVIII на рFVIII Successfull ITI with Haemoctin® SDH C. Biedlingmeier, Poster: Haemophilia
- 33. Природный стабилизатор фактора VIII: VWF В естественной плазме практически весь циркулирующий фактор VIII связан с белком-носителем
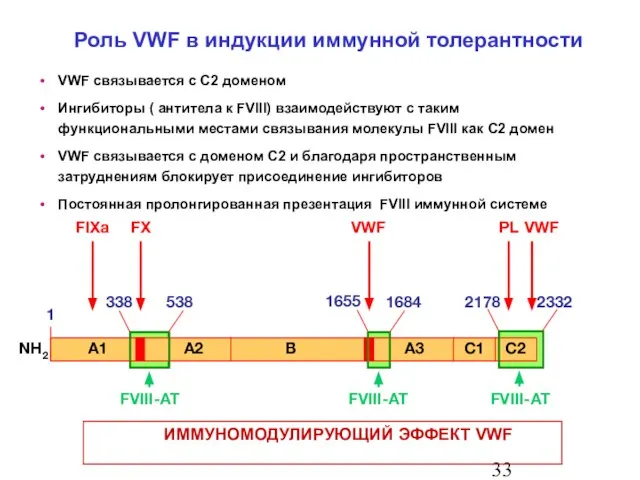
- 34. VWF связывается с C2 доменом Ингибиторы ( антитела к FVIII) взаимодействуют с таким функциональными местами связывания
- 35. Ингибиторная плазма с анти-C2-специфичностью проявляет более низкую ингибиторную активность с содержащими VWF концентратами FVIII по сравнению
- 36. Заметно более высокая recovery при инфузии концентрата F VIII с VWF при терапии пациентов с гемофилией
- 37. В клинических исследованиях показана большая эффективность комплексных концентратов VWF-FVIII при лечении по протоколу ИИТ Использование комплексных
- 38. Рекомендации консенсуса EHTSB (European Haemophilia Therapy Standardization Board): “VWF-содержащие концентраты FVIII являются средством выбора для пациентов,
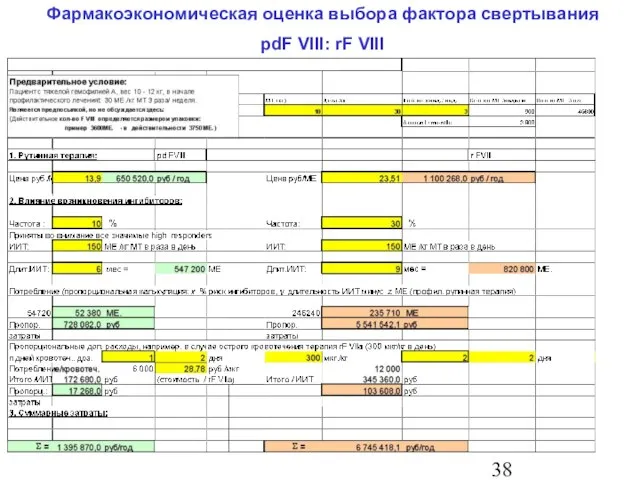
- 39. Фармакоэкономическая оценка выбора фактора свертывания pdF VIII: rF VIII
- 40. Фармакоэкономическая оценка выбора фактора свертывания pdF VIII: rF VIII 4. Выводы При терапии ребенка раннего возраста
- 41. Свойства идеального препарата FVIII Естественная структура комплекса FVIIIC / VWF: Соотношение: 100 I.U. FVIIIC / 31
- 43. Скачать презентацию
























 Презентация на тему Алгебра и логика высказываний
Презентация на тему Алгебра и логика высказываний Заболевание височно-нижнечелюстного сустава
Заболевание височно-нижнечелюстного сустава  Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия
Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия кольцово
кольцово Проблемы преемственности начального и основного (общего) образования
Проблемы преемственности начального и основного (общего) образования Проектная деятельность
Проектная деятельность Власть. Структурная и ситуационная власть
Власть. Структурная и ситуационная власть Свечникова В.В. правоведение тема 2 презентация
Свечникова В.В. правоведение тема 2 презентация Майолика. Гутные изделия. Ковка
Майолика. Гутные изделия. Ковка Saint Petersburg state University
Saint Petersburg state University 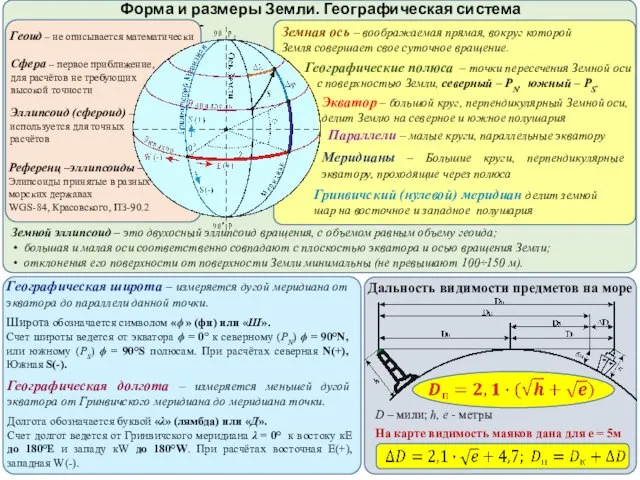 Форма и размеры Земли
Форма и размеры Земли Поздравление крестной жениха
Поздравление крестной жениха Гендерные аспекты образования и рынка труда
Гендерные аспекты образования и рынка труда Геометрия на службе у архитектуры
Геометрия на службе у архитектуры Психология двигательно-волевой сферы психической деятельности
Психология двигательно-волевой сферы психической деятельности Команда звёздочки
Команда звёздочки История семейного образования в СанктПетербурге
История семейного образования в СанктПетербурге Русский пейзаж в поэзии и живописи
Русский пейзаж в поэзии и живописи Физическая культура в период самоизоляции студентов педагогического вуза
Физическая культура в период самоизоляции студентов педагогического вуза Заповедники России
Заповедники России Презентация на тему Прощание с 1 классом
Презентация на тему Прощание с 1 классом Клёш и фалды
Клёш и фалды Быть нормальным
Быть нормальным Основные формы рельефа Алтайского края
Основные формы рельефа Алтайского края  Проект: Комплексное сопровождение покупки страховой компании
Проект: Комплексное сопровождение покупки страховой компании Сделка. Предпринимательская деятельность
Сделка. Предпринимательская деятельность русский язык - язык международного общения
русский язык - язык международного общения Условия признания и исполнения иностранных судебных решений
Условия признания и исполнения иностранных судебных решений