Содержание
- 2. Актуальность темы. Большой проблемой для здравоохранения являются заболевания суставов. По данным ВОЗ ими страдает около 4%
- 3. Цели и задачи. Цель работы: Повысить эффективность технологий дифференцировки стволовых клеток в хондрогенном направлении in vitro
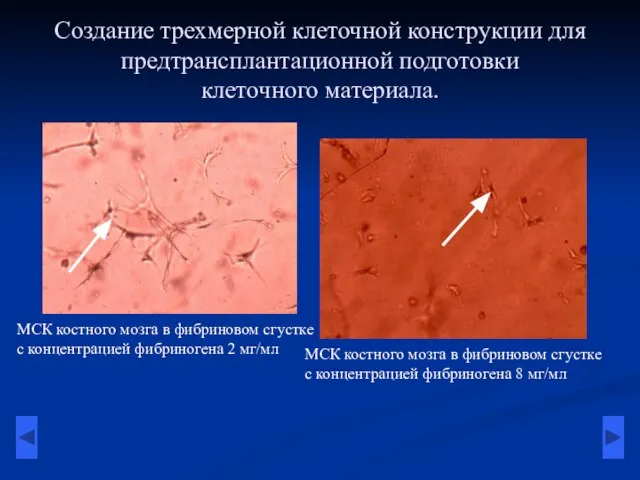
- 4. Создание трехмерной клеточной конструкции для предтрансплантационной подготовки клеточного материала. МСК костного мозга в фибриновом сгустке с
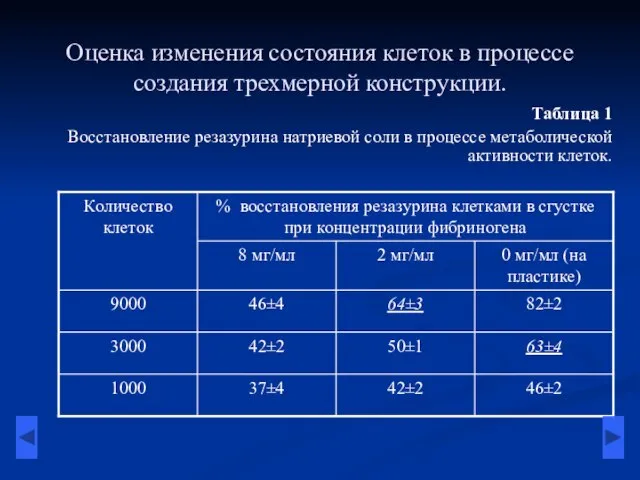
- 5. Оценка изменения состояния клеток в процессе создания трехмерной конструкции. Таблица 1 Восстановление резазурина натриевой соли в
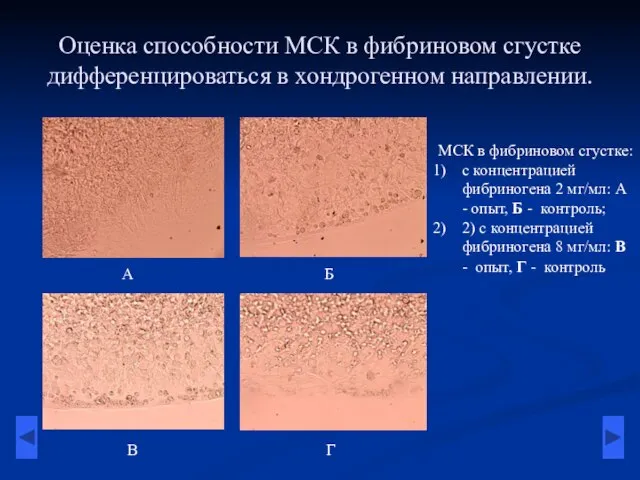
- 6. Оценка способности МСК в фибриновом сгустке дифференцироваться в хондрогенном направлении. МСК в фибриновом сгустке: с концентрацией
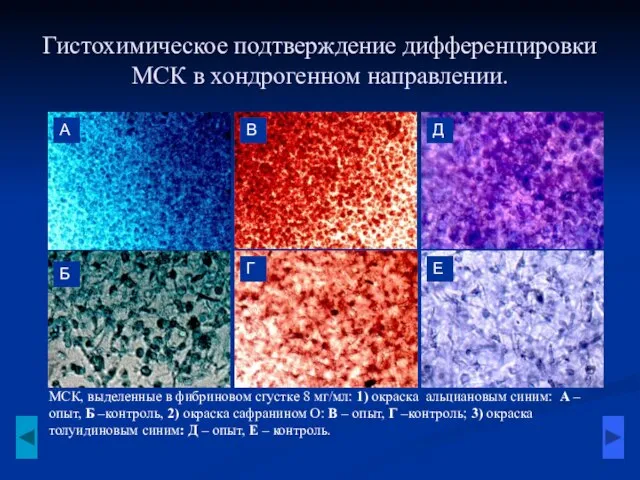
- 7. Гистохимическое подтверждение дифференцировки МСК в хондрогенном направлении. МСК, выделенные в фибриновом сгустке 8 мг/мл: 1) окраска
- 8. Подтверждение синтеза клетками кислых гликозаминогликанов – одних из основных продуктов хондроцитов. МСК в фибриновом сгустке: верхний
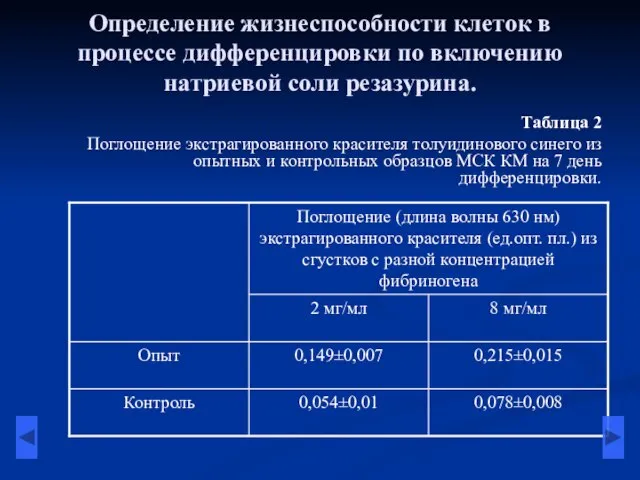
- 9. Определение жизнеспособности клеток в процессе дифференцировки по включению натриевой соли резазурина. Таблица 2 Поглощение экстрагированного красителя
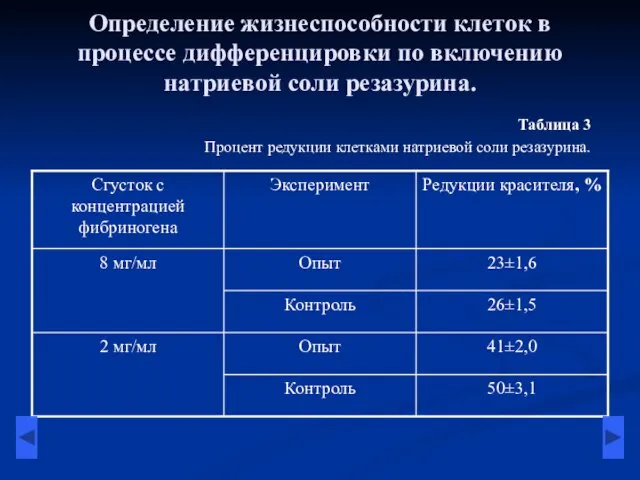
- 10. Определение жизнеспособности клеток в процессе дифференцировки по включению натриевой соли резазурина. Таблица 3 Процент редукции клетками
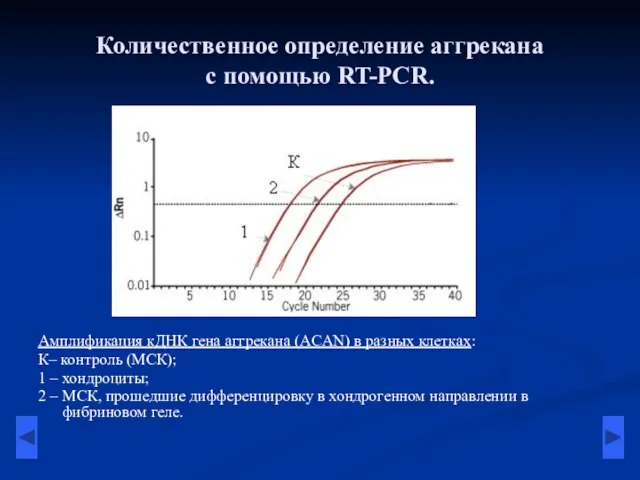
- 11. Количественное определение аггрекана с помощью RT-PCR. Амплификация кДНК гена аггрекана (ACAN) в разных клетках: К– контроль
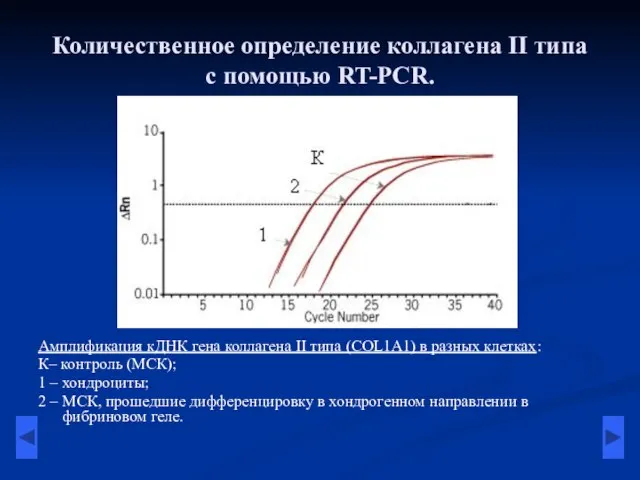
- 12. Количественное определение коллагена II типа с помощью RT-PCR. Амплификация кДНК гена коллагена II типа (COL1A1) в
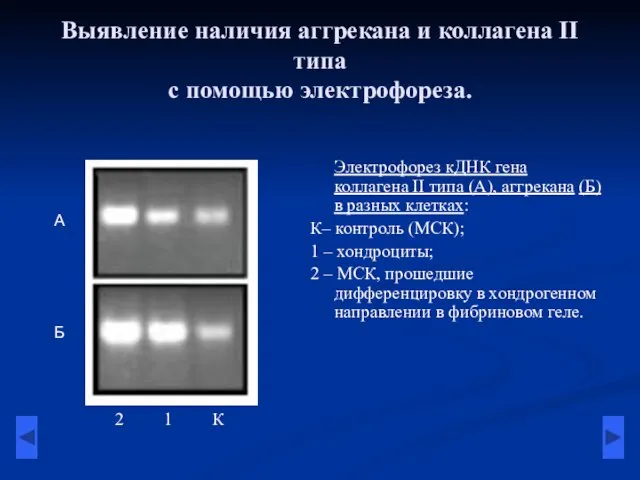
- 13. Выявление наличия аггрекана и коллагена II типа с помощью электрофореза. Электрофорез кДНК гена коллагена II типа
- 14. Заключение 1.Подобраны оптимальные концентрации компонентов для приготовления фибринового сгустка ( апротинин – 200 Ед/мл, хлорид кальция
- 16. Скачать презентацию




 или Мотивация работника – схемы материальных и нематериальных поощрений
или Мотивация работника – схемы материальных и нематериальных поощрений Freestyle сессия «Инвестиционно-банковские услуги для фарммедсектора»
Freestyle сессия «Инвестиционно-банковские услуги для фарммедсектора» По мере развития науки появляются новые признаки, и старые классификационные схемы оказываются недостаточными. Недостаточным ока
По мере развития науки появляются новые признаки, и старые классификационные схемы оказываются недостаточными. Недостаточным ока Инфразвук
Инфразвук Чрезвычайные происшествия техногенного характера. Химические аварии
Чрезвычайные происшествия техногенного характера. Химические аварии Семейное право
Семейное право Интернет-технологии на уроках информатики
Интернет-технологии на уроках информатики Гибридные ценные бумаги
Гибридные ценные бумаги Заказ в магазине Водакулершоп
Заказ в магазине Водакулершоп Накопительная система оценки в образовательном учреждении. Метод «портфолио».
Накопительная система оценки в образовательном учреждении. Метод «портфолио». Развитие рынков, бизнеса и маркетинга визменившихся условиях
Развитие рынков, бизнеса и маркетинга визменившихся условиях Саратовский государственный медицинский университет
Саратовский государственный медицинский университет Презентация на тему Австралия и океания
Презентация на тему Австралия и океания  Спортивно-патриотические мероприятие, посвященное Дню защитника Отечества “А ты готов?“
Спортивно-патриотические мероприятие, посвященное Дню защитника Отечества “А ты готов?“ Презентация на тему Определение в русском языке (8 класс)
Презентация на тему Определение в русском языке (8 класс) Выразительно – графические свойства композиции (точка, линия, пятно). Тема 1
Выразительно – графические свойства композиции (точка, линия, пятно). Тема 1 Université du troisième âge. Le français en ligne
Université du troisième âge. Le français en ligne Leading Supplier of Catering Equipment In UK
Leading Supplier of Catering Equipment In UK Гордиев узел
Гордиев узел ВОЗМОЖНАЯ ОБСТАНОВКА на территории муниципального образования в результате нападения вероятного противника
ВОЗМОЖНАЯ ОБСТАНОВКА на территории муниципального образования в результате нападения вероятного противника В. М. Гаршин «Лягушка-путешественница»
В. М. Гаршин «Лягушка-путешественница» История русского языка
История русского языка СКАЖИ КУРЕНИЮ НЕТ!
СКАЖИ КУРЕНИЮ НЕТ! Визитная карточка школы2009 – 2010 учебный год
Визитная карточка школы2009 – 2010 учебный год Структура дослідження обґрунтування актуальності і визначення теми дослідження, його мети, завдання
Структура дослідження обґрунтування актуальності і визначення теми дослідження, його мети, завдання Миссия «Безлимит без лишних условий»
Миссия «Безлимит без лишних условий»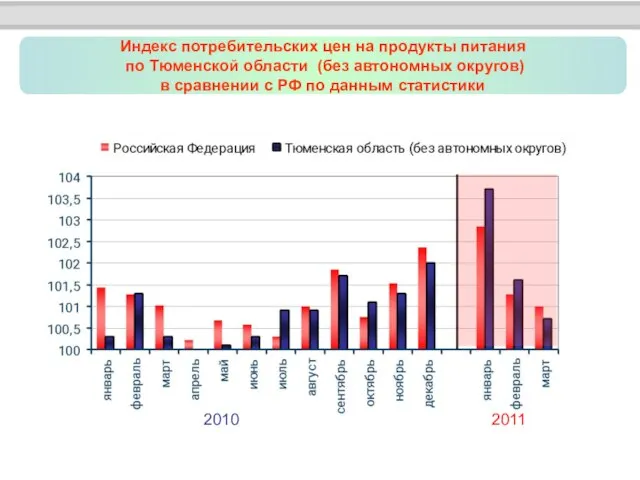 Индекс потребительских цен на продукты питания по Тюменской области (без автономных округов) в сравнении с РФ по данным статисти
Индекс потребительских цен на продукты питания по Тюменской области (без автономных округов) в сравнении с РФ по данным статисти Как добывается руда
Как добывается руда