Директор Фармакологического Центра Минздрава Украины Чумак Виктор Тимофеевич [email protected], http://www.pharma-center.kiev.ua/ АСПЕКТИ ФОРМУВА
Содержание
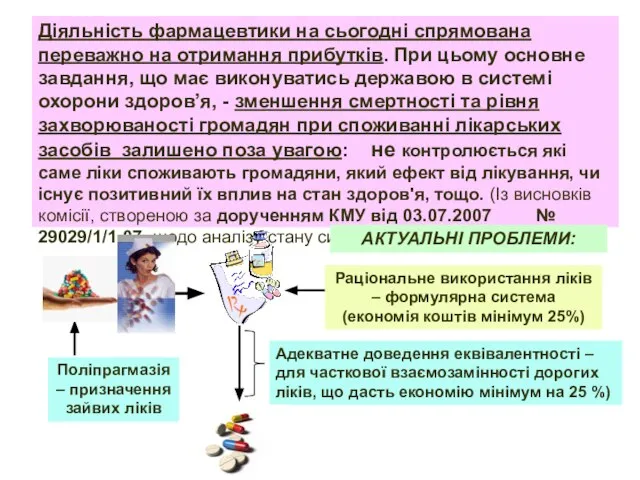
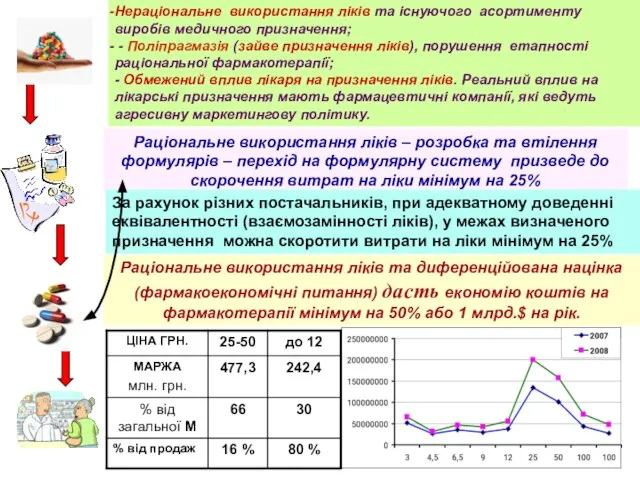
- 2. Поліпрагмазія – призначення зайвих ліків Раціональне використання ліків – формулярна система (економія коштів мінімум 25%) Адекватне
- 3. Програма діяльності Кабінету Міністрів України "Український прорив: для людей, а не політиків” 1.5. «ВИСОКОЯКІСНА І ДОСТУПНА
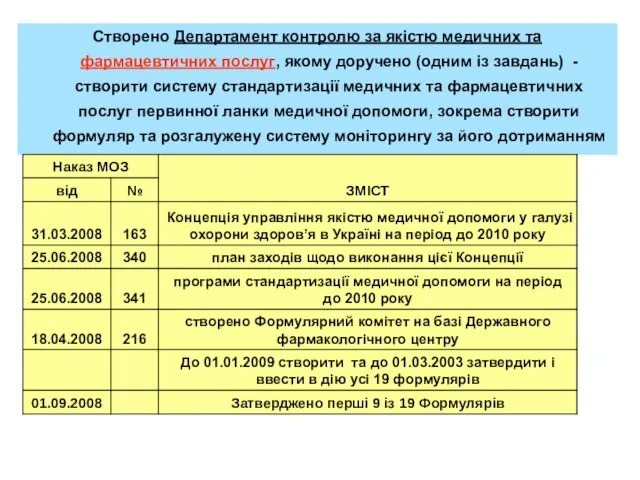
- 4. Створено Департамент контролю за якістю медичних та фармацевтичних послуг, якому доручено (одним із завдань) - створити
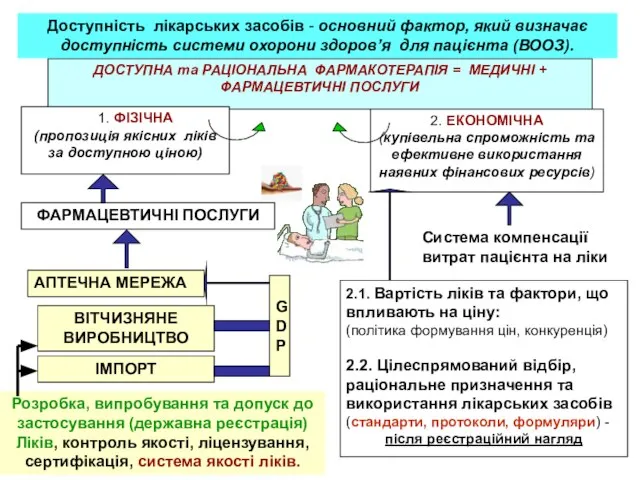
- 5. ДОСТУПНА та РАЦІОНАЛЬНА ФАРМАКОТЕРАПІЯ = МЕДИЧНІ + ФАРМАЦЕВТИЧНІ ПОСЛУГИ 1. ФІЗІЧНА (пропозиція якісних ліків за доступною
- 6. Нераціональне використання ліків та існуючого асортименту виробів медичного призначення; - Поліпрагмазія (зайве призначення ліків), порушення етапності
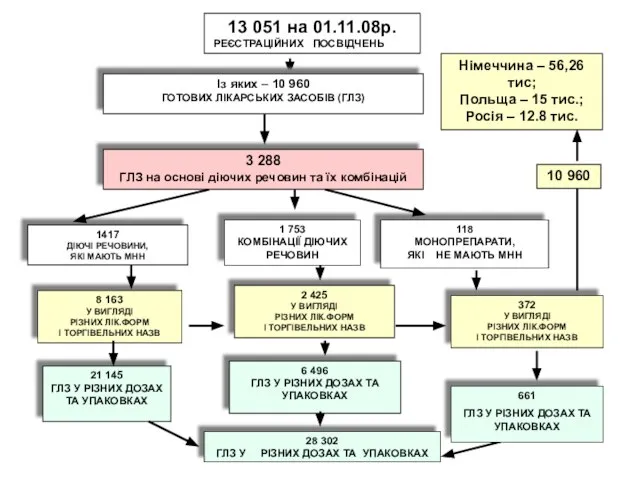
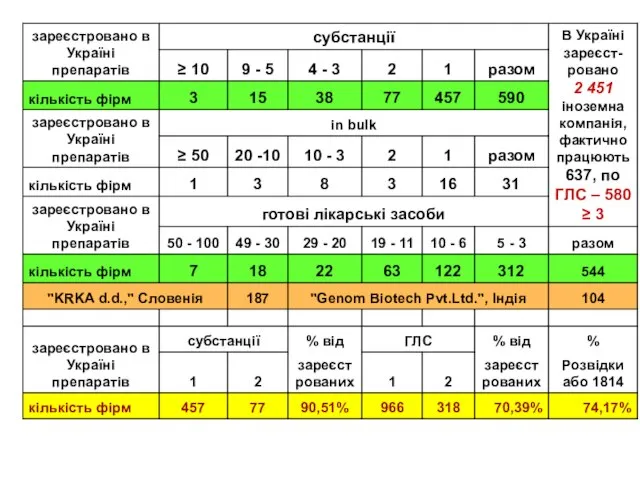
- 7. 13 051 на 01.11.08р. РЕЄСТРАЦІЙНИХ ПОСВІДЧЕНЬ Із яких – 10 960 ГОТОВИХ ЛІКАРСЬКИХ ЗАСОБІВ (ГЛЗ) 1417
- 9. ЕФЕКТИВНА ФАРМАКОТЕРАПІЯ залежить від 3-х факторів: ЯКОСТІ ЛІКАРСЬКОГО ЗАСОБУ; АДЕКВАТНИХ ДІЙ ЛІКАРЯ + КЛІНІЧНОГО ПРОВІЗОРА: Адекватного
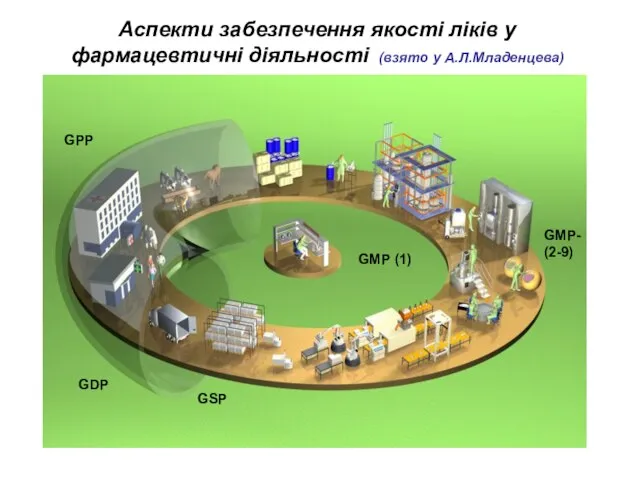
- 10. Аспекти забезпечення якості ліків у фармацевтичні діяльності (взято у А.Л.Младенцева)
- 11. СОВЕТСКИЕ ПРЕДСТАВЛЕНИЯ О ЛЕКАРСТВЕ – В ОТЛИЧИЕ ОТ ДИРЕКТИВЫ ЕС № 65/65 , 1965 г. Порядок
- 12. Система забезпечення якості лікарських засобів передбачає чіткі правила та процедури щодо питань (Наказ МОЗ № 838/17.12.2007):
- 13. ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ДЛЯ КОТОРЫХ ИССЛЕДОВАНИЕ БИЭКВИВАЛЕНТНОСТИ НЕ ПРОВОДЯТСЯ, так как взаимозаменяемость гарантируется доказательством соответствия фармакопейным спецификациям
- 14. Исследования биоэквивалентности методами in vitro Биофармацевтическая классификационная система Приказ МЗ № 426 от 28.06.2005/№ 95 от
- 15. КРИТЕРИИ ВЫБОРА МЕТОДА ОЦЕНКИ ЭКВИВАЛЕНТНОСТИ (ВЗАИМОЗАМЕНЯЕМОСТИ) Исследования in vitro проводят для препаратов в твердой дозированной форме
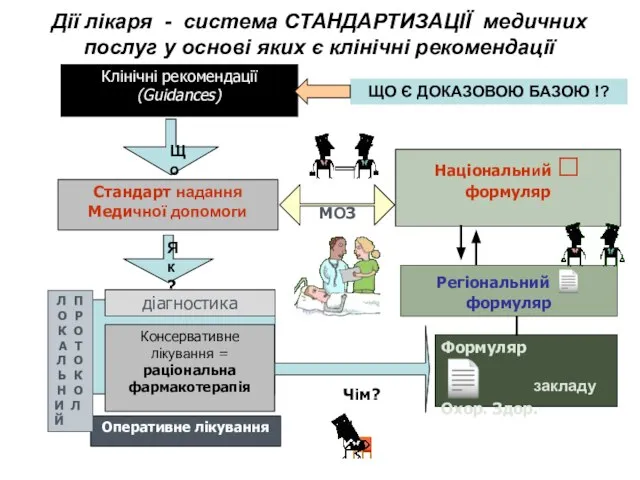
- 16. Дії лікаря - система СТАНДАРТИЗАЦІЇ медичних послуг у основі яких є клінічні рекомендації Клінічні рекомендації (Guidances)
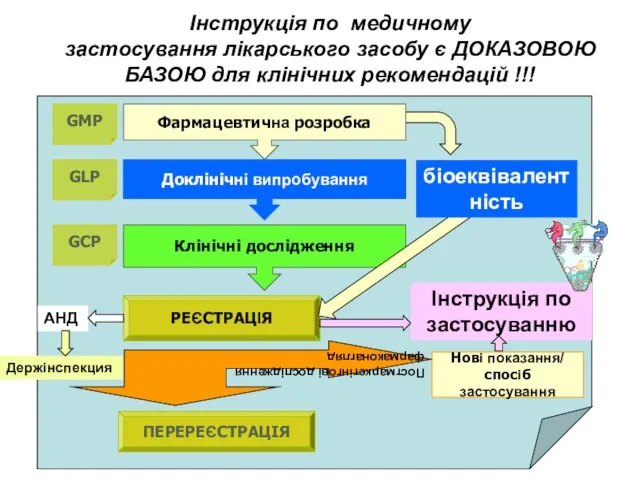
- 17. Інструкція по медичному застосування лікарського засобу є ДОКАЗОВОЮ БАЗОЮ для клінічних рекомендацій !!! Фармацевтична розробка Доклінічні
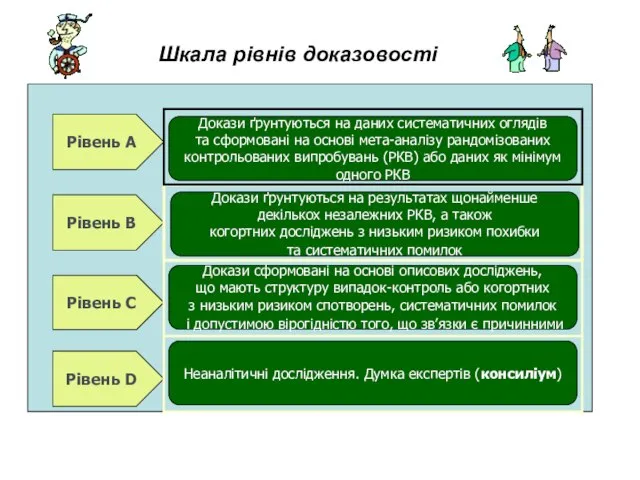
- 18. Шкала рівнів доказовості Рівень А Рівень В Рівень С Рівень D Неаналітичні дослідження. Думка експертів (консиліум)
- 19. Зміст формулярного керівництва Невідкладна допомога при гострих отруєннях Кардіологія. Лікарські засоби Гастроентерологія. Лікарські засоби Пульмонологія. Лікарські
- 20. Зміст формулярного керівництва ДОДАТОК 1. Наказ МОЗ України від 19.07.2005 №360 «Про затвердження Правил виписування рецептів
- 21. Основні принципи наповнення національного формулярного керівництва Доведені ефективність та безпечність ЛЗ, Інструкція для медичного застосування оригінального
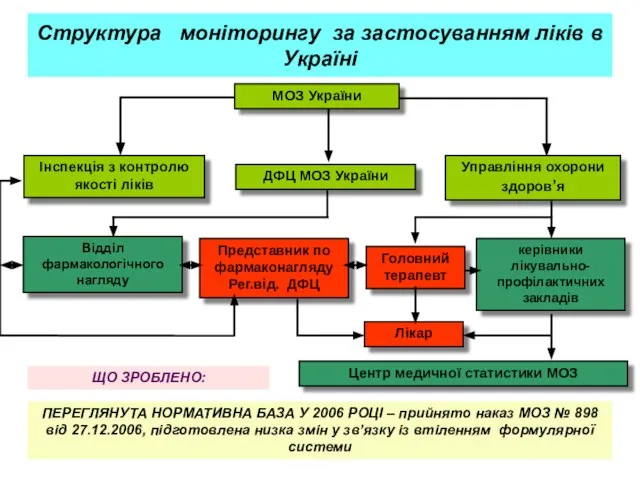
- 22. Структура моніторингу за застосуванням ліків в Україні ЩО ЗРОБЛЕНО: ПЕРЕГЛЯНУТА НОРМАТИВНА БАЗА У 2006 РОЦІ –
- 24. Скачать презентацию










 Сказкотерапия в работе с детьми раннего возраста с нарушением слуха
Сказкотерапия в работе с детьми раннего возраста с нарушением слуха Мебель. Стул
Мебель. Стул Уроки «Введение в православную отечественную культуру» в начальной школе
Уроки «Введение в православную отечественную культуру» в начальной школе Экономические основы налогоообложения. Принципы и методы налогообложения
Экономические основы налогоообложения. Принципы и методы налогообложения Каналы рекламной коммуникации и средства рекламы
Каналы рекламной коммуникации и средства рекламы  Моя цветочная полянка
Моя цветочная полянка Презентация к уроку математики в 1 классе по УМК «Школа России»
Презентация к уроку математики в 1 классе по УМК «Школа России» Сущность и методологические основы управления организацией
Сущность и методологические основы управления организацией День Земли
День Земли СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО «
СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО « Школьный бизнес-стартап
Школьный бизнес-стартап Рынок ценных бумаг
Рынок ценных бумаг Презентация по английскому языку _Oscar Wilde_
Презентация по английскому языку _Oscar Wilde_ The 25 th of December is Christmas
The 25 th of December is Christmas Остановись, мгновение! (к истории возникновения и развития фотографии)
Остановись, мгновение! (к истории возникновения и развития фотографии) Веб-аналитика в 2011 году
Веб-аналитика в 2011 году Организационная структура вооруженных сил РФ
Организационная структура вооруженных сил РФ Плавание и его воздействие на развитие системы опорно-двигательного аппарата
Плавание и его воздействие на развитие системы опорно-двигательного аппарата Лечение и профилактика синдрома смежного уровня
Лечение и профилактика синдрома смежного уровня Строительный рынок в Росиии. Алексеев Дмитрий гр.ПИ-07
Строительный рынок в Росиии. Алексеев Дмитрий гр.ПИ-07 Основные положения Таможенного кодекса таможенного союзаТаможенная служба Республики КазахстанБрюссель, 25 января 2010 года
Основные положения Таможенного кодекса таможенного союзаТаможенная служба Республики КазахстанБрюссель, 25 января 2010 года Курс S60 days for result
Курс S60 days for result Половое размножение растений
Половое размножение растений Вредные привычки – нам не друзья
Вредные привычки – нам не друзья Presentation Title
Presentation Title  Практика работы на компьютере 3 класс
Практика работы на компьютере 3 класс Психологическая теория возникновения права
Психологическая теория возникновения права Электробалластер ЭЛБ-4
Электробалластер ЭЛБ-4