Содержание
- 2. Двойственная природа электрона Электрон имеет массу и заряд, как частица. Электрон проявляет волновые свойства – способен
- 3. Электрон в атоме может находиться в любой точке пространства вокруг ядра, однако вероятность его пребывания в
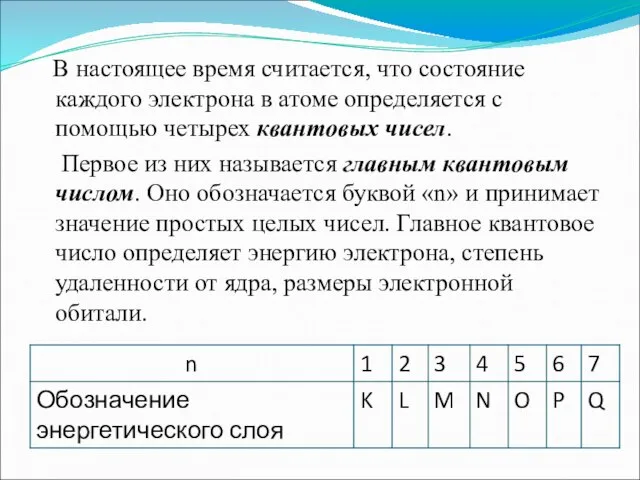
- 4. В настоящее время считается, что состояние каждого электрона в атоме определяется с помощью четырех квантовых чисел.
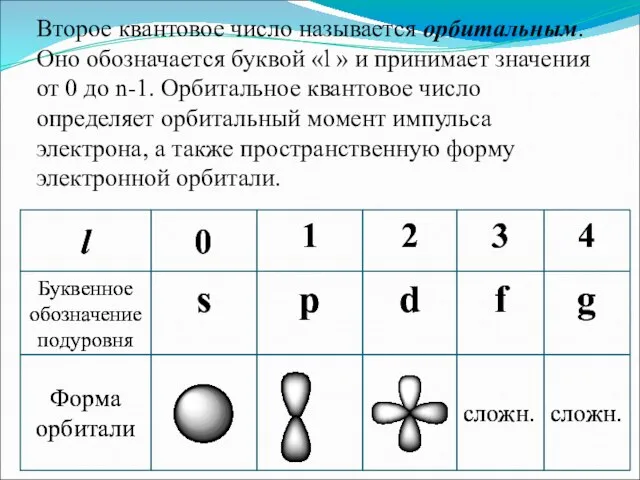
- 5. Второе квантовое число называется орбитальным. Оно обозначается буквой «l » и принимает значения от 0 до
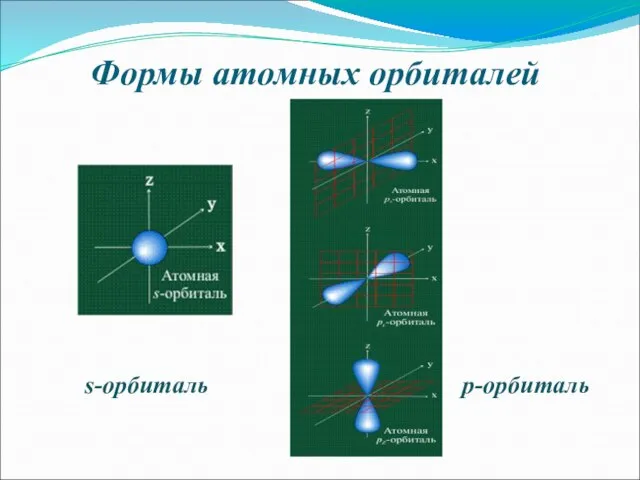
- 6. Формы атомных орбиталей s-орбиталь p-орбиталь
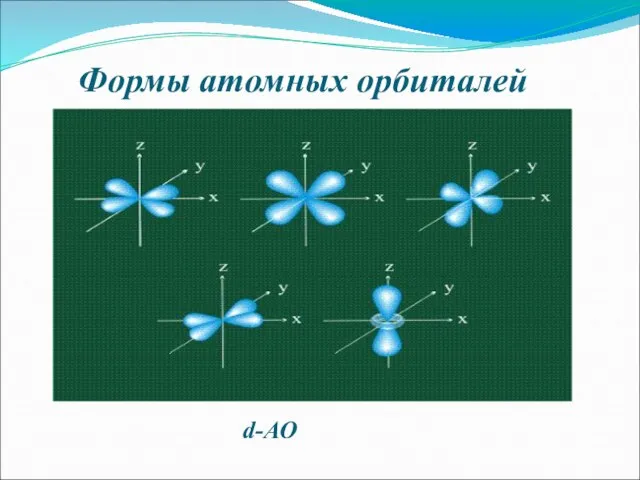
- 7. Формы атомных орбиталей d-АО
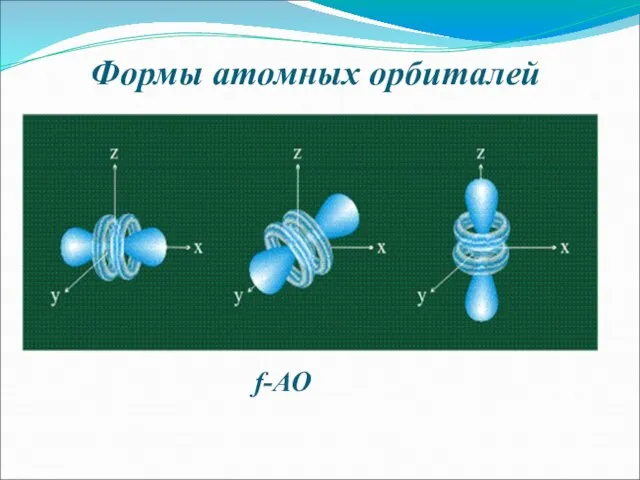
- 8. Формы атомных орбиталей f-АО
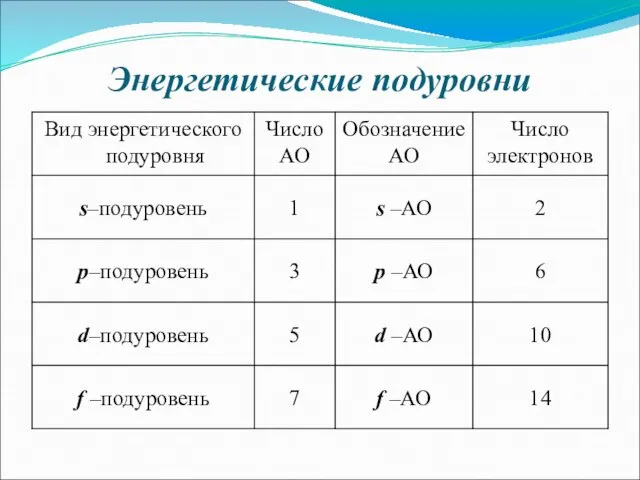
- 9. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Энергетический подуровень – это совокупность электронных
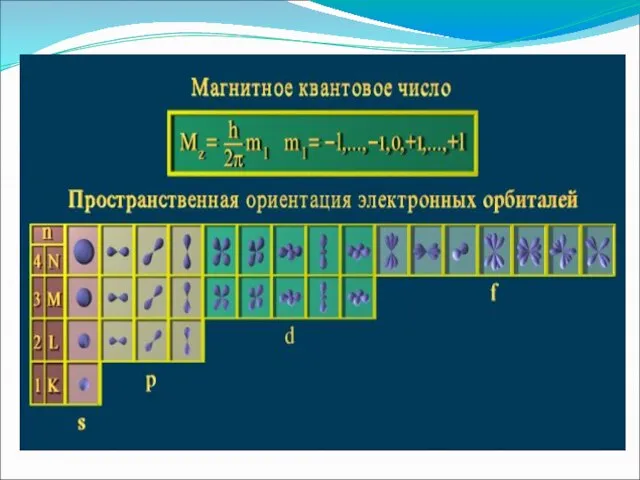
- 10. Магнитное квантовое число ml определяет значения проекции орбитального момента на одной из осей, а также пространственную
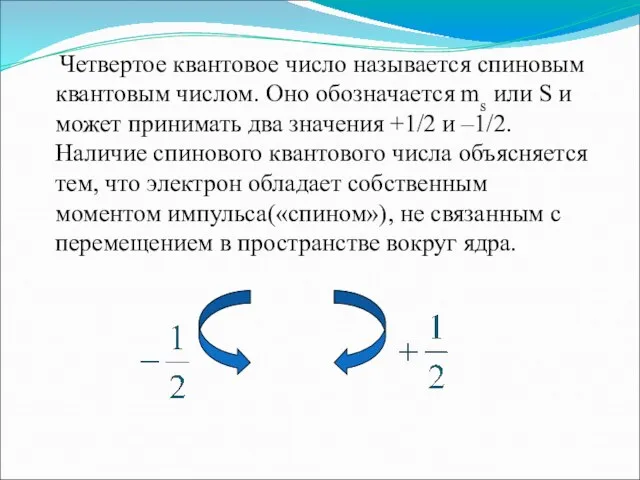
- 12. Четвертое квантовое число называется спиновым квантовым числом. Оно обозначается ms или S и может принимать два
- 13. Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух
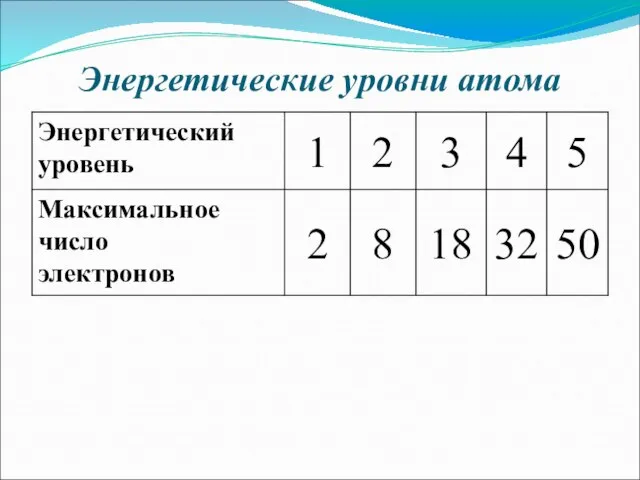
- 14. Энергетические уровни атома
- 15. Энергетические подуровни
- 16. Ссылки на интернет-источники 1. Статья «Квантовые числа электрона»: http://www.chemistry.ru/course/content/chapter2/section/paragraph2/theory.html 2. Статья «Квантовые числа электрона»: http://www.himhelp.ru/section23/section2/section9/ 3.
- 18. Скачать презентацию






 Необычный отель
Необычный отель Состав ПК Компьютерная система
Состав ПК Компьютерная система 孔子学院在乌克兰和俄罗斯
孔子学院在乌克兰和俄罗斯 Places and Perspectives
Places and Perspectives Ресурси страховика
Ресурси страховика Метрическая система мер
Метрическая система мер Успешность адаптации ребенка при переходе со ступени начального образования – на основную
Успешность адаптации ребенка при переходе со ступени начального образования – на основную Istambek
Istambek Правила поведения итехники безопасности в кабинете информатики.
Правила поведения итехники безопасности в кабинете информатики. Город как среда обитания (5 класс)
Город как среда обитания (5 класс) Почему нужно чистить зубы?
Почему нужно чистить зубы? Автоматизированная система управления качеством вуза
Автоматизированная система управления качеством вуза Айдентика. Корпоративная идентификация
Айдентика. Корпоративная идентификация Повесть «Детство»
Повесть «Детство» Design Reboot
Design Reboot Клуб Алтын, доход посредством роста курса внутренней монеты
Клуб Алтын, доход посредством роста курса внутренней монеты Перспективы участия иностранных банков в развитии ритейлового бизнеса в российских регионах
Перспективы участия иностранных банков в развитии ритейлового бизнеса в российских регионах Работа с заданиями на анализ исторических версий и оценок.
Работа с заданиями на анализ исторических версий и оценок. Подготовка к ЕГЭ. (окончания глаголов и суффиксов причастий)
Подготовка к ЕГЭ. (окончания глаголов и суффиксов причастий) Проблемы начала правоприменения в сфере борьбы с картелями – опыт Бразилии
Проблемы начала правоприменения в сфере борьбы с картелями – опыт Бразилии Сложноподчиненные предложения с определительными придаточными
Сложноподчиненные предложения с определительными придаточными Фразеологическое ядро старославянского языка
Фразеологическое ядро старославянского языка План развития ЮФО 2020
План развития ЮФО 2020 Конструктивизм
Конструктивизм Мартиничка
Мартиничка Электронное портфолио ученика
Электронное портфолио ученика Магистерская программа 031100.68.20 Сопоставительное изучение культур и межкультурная коммуникация
Магистерская программа 031100.68.20 Сопоставительное изучение культур и межкультурная коммуникация Презентация на тему Украшение пасхального яйца
Презентация на тему Украшение пасхального яйца