Слайд 2ЦЕЛИ УРОКА:
1. Сформировать понятия об электролитах и неэлектролитах.
2. Рассмотреть механизм диссоциации веществ

с ковалентной полярной и ионной связью.
3.Ввести понятие степень диссоциации.
Слайд 3САМОСТОЯТЕЛЬНАЯ РАБОТА
1. В 50 г воды растворили 50 г щелочи. Вычислите массу

полученного раствора и массовую долю щелочи в растворе.
2. Используя рисунок 24 стр. 134 сравните растворимость нитрата калия и хлорида натрия при 60 градусах.
Слайд 4Виды связи в соединениях
Ковалентная ( полярная и неполярная)- это связь, образованная с

помощью общих электронных пар.
Ионная связь- связь между ионами, осуществляемая электростатическим притяжением.
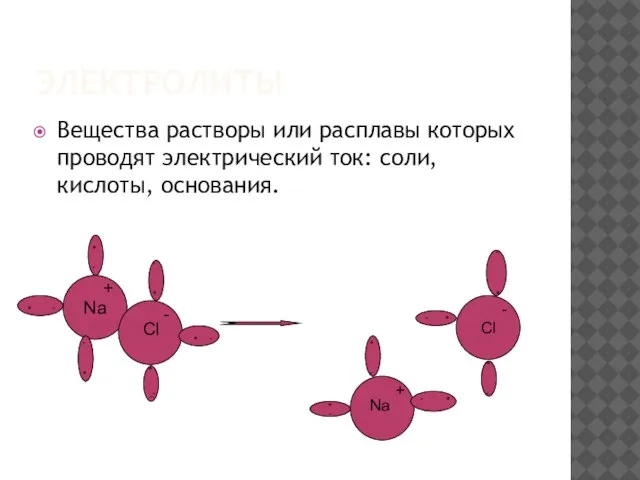
Слайд 5электролиты
Вещества растворы или расплавы которых проводят электрический ток: соли, кислоты, основания.
Na
+
Cl
-
-
+
-
+
-
+
+
+
+
_
-
-
-
Cl
Na
+
-
+ -
-
-
Слайд 6неэлектролиты
Вещества растворы и расплавы которых тока не проводят
Простые вещества
Органические вещества
Нерастворимые оксиды и

т. д.
Слайд 7ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
РАСПАД ЭЛЕКТРОЛИТА НА ИОНЫ ПРИ РАСТВОРЕНИИ ИЛИ РАСПЛАВЛЕНИИ
Ориентация
Гидратация
Диссоциация
Для веществ с

ионной связью
Слайд 8Электролитическая диссоциация
Для веществ с ковалентной полярной связью
Ориентация
Гидратация
Ионизация
Диссоциация

Слайд 9Упражнения:
Уравнения диссоциации:
NaOH = Na + OH
K Cl = K +

Cl
H Cl = H + Cl
K2SO4 = 2K +SO4
+
-
+
-
+
-
+
2-








 Требования к подготовке специалистов по разработке программного обеспечения
Требования к подготовке специалистов по разработке программного обеспечения Понятие «материя» и «дух». Смысл трансформации понятия «бытие» в понятие «материя» в диалектическом материализме
Понятие «материя» и «дух». Смысл трансформации понятия «бытие» в понятие «материя» в диалектическом материализме Развивающая предметно-пространственная среда, как средство приобщения к основам безопасности жизнедеятельности детей
Развивающая предметно-пространственная среда, как средство приобщения к основам безопасности жизнедеятельности детей Киста бартолиновой железы
Киста бартолиновой железы Астрахань, улица Соликамская, 12
Астрахань, улица Соликамская, 12 Конкурентная война
Конкурентная война РГПУ им. А.И. Герцена. Институт дефектологического образования и реабилитации
РГПУ им. А.И. Герцена. Институт дефектологического образования и реабилитации Презентация на тему Подготовка к сочинению
Презентация на тему Подготовка к сочинению Культура Спортивные достижения СССР 1964 - 1985гг.
Культура Спортивные достижения СССР 1964 - 1985гг. Смутное время 1598-1613 гг. и его последствия Великий Новгород и Шведское королевство
Смутное время 1598-1613 гг. и его последствия Великий Новгород и Шведское королевство Российско-швейцарская компания Алмафуд. Производство натурального и растворимого кофе
Российско-швейцарская компания Алмафуд. Производство натурального и растворимого кофе Живопись Средних веков
Живопись Средних веков Фрагмент отчета о работе кафедры «Экономики промышленности и организации предприятий»за 5 лет (2004 – 2008 г.г.)Рогалёв Н.Д.
Фрагмент отчета о работе кафедры «Экономики промышленности и организации предприятий»за 5 лет (2004 – 2008 г.г.)Рогалёв Н.Д. Понятие уголовного права
Понятие уголовного права Реформы Петра I
Реформы Петра I Эфирные масла dōTERRA
Эфирные масла dōTERRA 841967434.177892185281158787.1.1
841967434.177892185281158787.1.1 Дом с колокольчиком
Дом с колокольчиком ЯЗЫКИ ПРОГРАММИРОВАНИЯ С РАСШИРЯЕМЫМ СИНТАКСИСОМ
ЯЗЫКИ ПРОГРАММИРОВАНИЯ С РАСШИРЯЕМЫМ СИНТАКСИСОМ Автоматизированная система управления учета и дозирования стройматериалов на РБУ
Автоматизированная система управления учета и дозирования стройматериалов на РБУ Определение синуса, косинуса, тангенса и котангенса углов поворота
Определение синуса, косинуса, тангенса и котангенса углов поворота Итоги экспертной встречи «Новые стратегии НКС в условиях кризиса»
Итоги экспертной встречи «Новые стратегии НКС в условиях кризиса» Законы Менделя
Законы Менделя Презентация на тему Дисциплинарная и материальная ответственность за экологические правонарушения
Презентация на тему Дисциплинарная и материальная ответственность за экологические правонарушения  ОТЧЕТЫ ДЛЯ СИСТЕМЫ ЭЛЕКТРОННОГО ДОКУМЕНТООБОРОТА «ДЕЛО-ПРЕДПРИЯТИЕ»
ОТЧЕТЫ ДЛЯ СИСТЕМЫ ЭЛЕКТРОННОГО ДОКУМЕНТООБОРОТА «ДЕЛО-ПРЕДПРИЯТИЕ» Контур.Экстерн для участников проекта Прямые выплаты
Контур.Экстерн для участников проекта Прямые выплаты Дезоксирибонуклеиновая кислота
Дезоксирибонуклеиновая кислота Презентация на тему Организация проектной деятельности учащихся на уроках биологии
Презентация на тему Организация проектной деятельности учащихся на уроках биологии