Слайд 2Электролиз – окислительно-восстановительный процесс, происходящий на электродах при пропускании постоянного электрического тока

через раствор или расплав электролита.
Слайд 3Катод – электрод, на котором при разложении вещества электрическим током происходит восстановление.
Анод
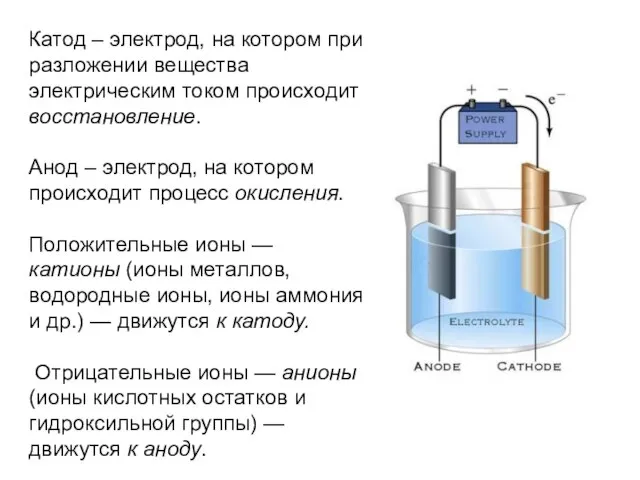
– электрод, на котором происходит процесс окисления.
Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду.
Отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Слайд 4Процессы происходящие на катоде (смотри ряд напряжений металлов!)
Если катион электролита расположен в

ряду напряжений в начале ряда по Al включительно, то на катоде выделяется H2.
Если катион электролита в ряду напряжений расположен между Al и H2, то на катоде выделяется металл (~90%) и H2.
Слайд 53) Если катион электролита в ряду напряжений стоит после H2, то на
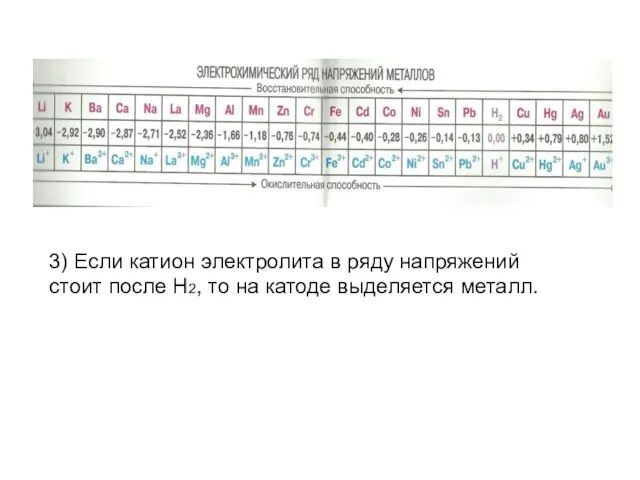
катоде выделяется металл.
Слайд 6Процессы происходящие на аноде
При электролизе растворов солей безкислородных кислот (кроме HF (фторидов))

на аноде образуются простые вещества.
При электролизе раствора кислородосодержащих солей и фторидов на аноде выделяется О2.
Слайд 7
Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных
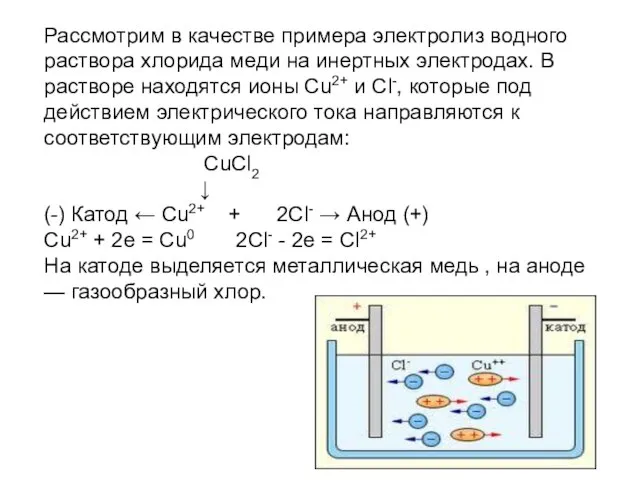
электродах. В растворе находятся ионы Cu2+ и Cl-, которые под действием электрического тока направляются к соответствующим электродам:
CuCl2
↓
(-) Катод ← Cu2+ + 2Cl- → Анод (+) Cu2+ + 2e = Cu0 2Cl- - 2e = Cl2+
На катоде выделяется металлическая медь , на аноде — газообразный хлор.
Слайд 8
Если в расплав хлорида натрия (NaCl), опустить электроды и пропускать постоянный
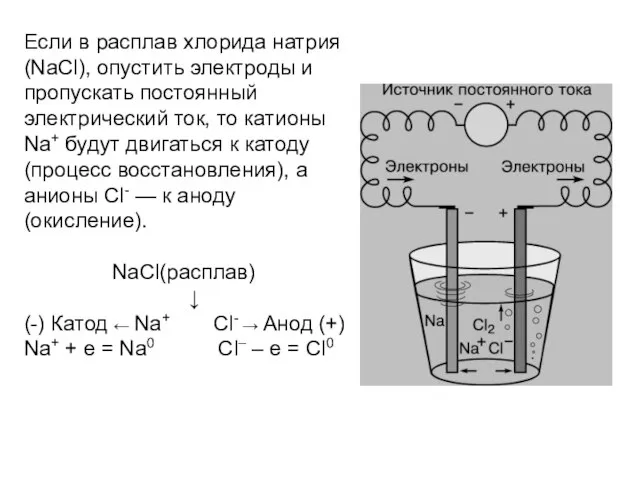
электрический ток, то катионы Na+ будут двигаться к катоду (процесс восстановления), а анионы Cl- — к аноду (окисление).
NaCl(расплав)
↓
(-) Катод ← Na+ Cl- → Анод (+)
Na+ + e = Na0 Cl– – e = Cl0
Слайд 9Применение электролиза
Явление электролиза широко применяется в современной промышленности. В частности, электролиз

является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование).
Слайд 10Электролизом пользуются для покрытия металлических предметов никелем, хромом, цинком, оловом, золотом и

т.д.
Слайд 11Электролиз находит применение в очистке воды – удаление из нее растворимых примесей.

В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной).










 Электролиты
Электролиты Лаборатория Медиа-море. Копирайтинг
Лаборатория Медиа-море. Копирайтинг Национальные особенности и культура испанцев
Национальные особенности и культура испанцев 5 урок с Гибким Павлом
5 урок с Гибким Павлом Презентация на тему Королева Елизавета II
Презентация на тему Королева Елизавета II  Особенности дошкольного образования в Финляндии
Особенности дошкольного образования в Финляндии Михаил Васильевич Ломоносов.Оды.
Михаил Васильевич Ломоносов.Оды. Особенности аутокоммуникации в подростковом возрасте
Особенности аутокоммуникации в подростковом возрасте ARCHERS поиск и подбор персоналаexecutive search
ARCHERS поиск и подбор персоналаexecutive search Мои работы
Мои работы Презентация на тему Физиологические эффекты активных форм кислорода
Презентация на тему Физиологические эффекты активных форм кислорода  Политическая сфера
Политическая сфера Star signs
Star signs Инвестиции в системе социальной ответственности бизнеса
Инвестиции в системе социальной ответственности бизнеса Что?
Что? Гравити Фоллз. Книга 3
Гравити Фоллз. Книга 3 Стиль рококо
Стиль рококо Архитектура эпохи Античности
Архитектура эпохи Античности Крутятся диски
Крутятся диски Как правильно построить презентацию авиакомпании для страхового рынка
Как правильно построить презентацию авиакомпании для страхового рынка Индия на карте мира
Индия на карте мира Декларация прав ребенка
Декларация прав ребенка Описание торгового предприятия
Описание торгового предприятия Проектные задачи как новая форма учебной деятельности в начальной школе Курсы повышения квалификации Подготовил: Лев-Толстовски
Проектные задачи как новая форма учебной деятельности в начальной школе Курсы повышения квалификации Подготовил: Лев-Толстовски Презентация на тему Части растения Окружающий мир ( 1 класс )
Презентация на тему Части растения Окружающий мир ( 1 класс )  Маркетинг территорий как философия и практическая деятельность
Маркетинг территорий как философия и практическая деятельность Засушливые зоны умеренного пояса
Засушливые зоны умеренного пояса Презентация на тему СИЛА ТЯЖЕСТИ Силы в механике
Презентация на тему СИЛА ТЯЖЕСТИ Силы в механике