Содержание
- 2. Понятие о двойном электрическом слое (ДЭС) При погружении металлической пластинки (например цинковой) в чистую воду, то
- 4. Водородный электрод состоит из платины, покрытой платиновой чернью. Платина помещена в раствор серной кислоты. Через раствор
- 5. Стандартные электродные потенциалы принято относить к электродным полуреакциям восстановления, и по этой причине их называют стандартными
- 6. Гальванический элемент. Элемент Даниэля- Якоби Гальваническим элементом называется любое устройство, в котором энергия химической реакции непосредственно
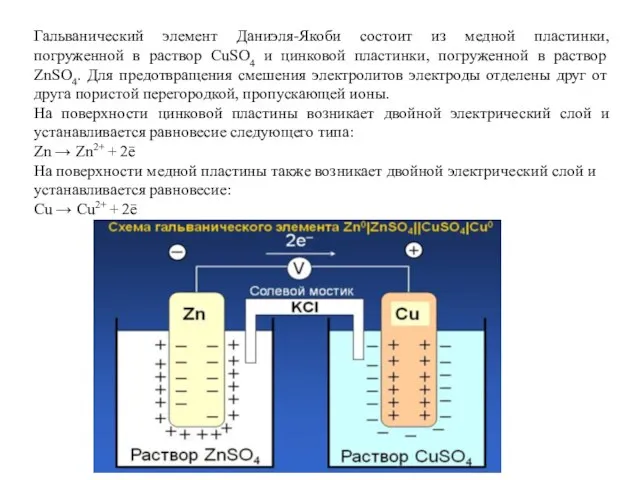
- 7. Гальванический элемент Даниэля-Якоби состоит из медной пластинки, погруженной в раствор СuSO4 и цинковой пластинки, погруженной в
- 8. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного, поэтому при замыкании внешней цепи электроны
- 9. Уравнение Нернста Потенциал Е электрода рассчитывают по формуле Нернста: где аOx и aRed – активности окисленной
- 10. Концентрационные гальванические элементы Концентрационные элементы - гальванические элементы, в которых электрическая энергия получается за счет выравнивания
- 11. Окислительно-восстановительные гальванические элементы Особенностью данных элементов является то, что 1) металл электрода (обычно платина) не принимает
- 12. Классификация электродов Условно все известные электроды можно разделить на 3 основные группы: металлические, электроды сравнения и
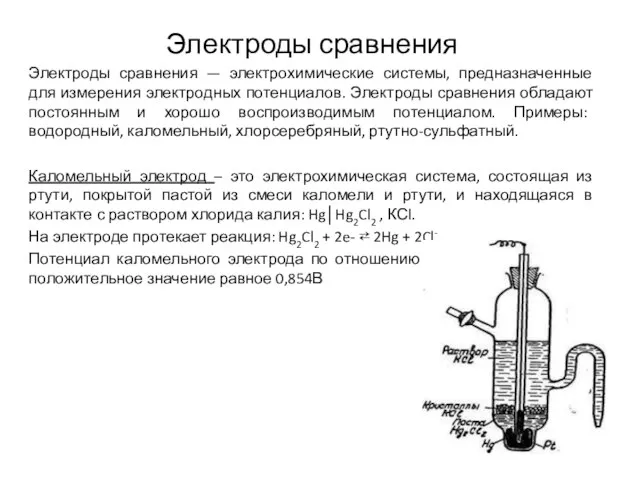
- 13. Электроды сравнения Электроды сравнения — электрохимические системы, предназначенные для измерения электродных потенциалов. Электроды сравнения обладают постоянным
- 14. Хлорсеребряный электрод представляет собой серебряную пластинку, покрытую слоем хлорида серебра и погруженную в раствор содержащий ионы
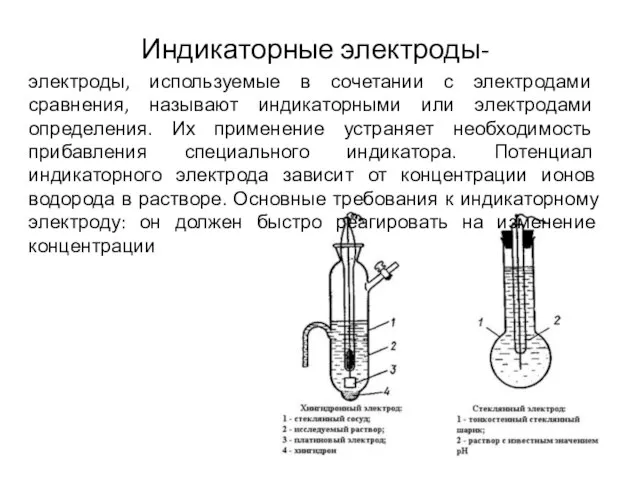
- 15. Индикаторные электроды- электроды, используемые в сочетании с электродами сравнения, называют индикаторными или электродами определения. Их применение
- 16. Хингидронный электрод Электрод представляет собой платиновую проволоку, опущенную в насыщенный раствор хингидронаС6Н4О2·С6Н4(ОН)2 Потенциалообразующей является следующая реакция:
- 18. Скачать презентацию












 1С-Битрикс Корпоративный портал 10.0 – 10.5
1С-Битрикс Корпоративный портал 10.0 – 10.5 Presentation Title
Presentation Title  Заседание ученого советаПОИПКРО
Заседание ученого советаПОИПКРО СОЦИАЛЬНЫЙ ПРОЕКТ «Там на ухоженных дорожках»
СОЦИАЛЬНЫЙ ПРОЕКТ «Там на ухоженных дорожках» Цель, Процесс, Результат
Цель, Процесс, Результат Гражданское право РФ. Право собственности и иные вещные права
Гражданское право РФ. Право собственности и иные вещные права Энергосбережение в нашей жизни УО «ВГПЛ1 машиностроения им. М.Ф.Шмырева» http://vgpl-1.iatp.by. - презентация
Энергосбережение в нашей жизни УО «ВГПЛ1 машиностроения им. М.Ф.Шмырева» http://vgpl-1.iatp.by. - презентация Интегрированное занятие « Математика + история»
Интегрированное занятие « Математика + история» Тестовые задания
Тестовые задания 3_Биологическая роль воды
3_Биологическая роль воды Презентация на тему Умножение одночлена на многочлен
Презентация на тему Умножение одночлена на многочлен  Иван Сергеевич Тургенев. Начало творческого пути писателя
Иван Сергеевич Тургенев. Начало творческого пути писателя Геометрическая абстракция
Геометрическая абстракция Угол. Сравнение углов. Биссектриса угла
Угол. Сравнение углов. Биссектриса угла Конфликты в семье
Конфликты в семье Вот он цветочек аленький
Вот он цветочек аленький Итоги 2003/2004 учебного года и задачи кафедр по повышению качества подготовки специалистов в новом учебном году Б.Е.Ды
Итоги 2003/2004 учебного года и задачи кафедр по повышению качества подготовки специалистов в новом учебном году Б.Е.Ды Витамин D
Витамин D Профессия Повар-кондитер
Профессия Повар-кондитер Неделя английского языка2011-2012
Неделя английского языка2011-2012 История математической логики
История математической логики Япония 11 класс
Япония 11 класс Склады и пункты приема поставок
Склады и пункты приема поставок Информационно-аналитический проект: Сто дней
Информационно-аналитический проект: Сто дней Тех. задание
Тех. задание Возможности развития познавательной мотивации учащихся.
Возможности развития познавательной мотивации учащихся. Николай Константинович Рерих (874 - 1947)
Николай Константинович Рерих (874 - 1947) Внешняя память компьютера
Внешняя память компьютера