Содержание
- 3. Теория Аррениуса применима только для слабых электролитов. Для слабых электролитов не учитывается действие электростатических сил между
- 4. Для оценки способности ионов к химическим реакциям в растворах сильных электролитов пользуются понятием активность ионов. Активность
- 5. Ионная сила раствора (I) –величина, характеризующая интенсивность электростатического поля всех ионов в растворе Равна полусумме произведений
- 6. Электропроводность растворов электролитов
- 7. Способность растворов электролитов проводить электрический ток характеризуется электропроводностью (или обратной ей величиной сопротивления). Электропроводность L рассчитывается
- 8. Зависимость удельной электропроводности электролитов от концентрации (1 – H2SO4, 2 – KOH, 3 – CH3COOH)
- 12. Практическое применение метода измерения электропроводности Кондуктометрия- метод анализа, снованный на определении электропроводности жидких сред. Измерение степени
- 14. Скачать презентацию
Слайд 3Теория Аррениуса применима только для слабых электролитов.
Для слабых электролитов не учитывается
Теория Аррениуса применима только для слабых электролитов.
Для слабых электролитов не учитывается

действие электростатических сил между разноименно заряженными ионами. Так как концентрация ионов в растворах слабых электролитов невелика и ионы находятся на достаточно больших расстояниях друг от друга, такое упрощение допускается. Но в растворах сильных электролитов концентрация ионов достаточно высока, а расстояния между ними невелики. Это учтено при создании теории сильных электролитов (разработана голландским ученым Петером Дебаем и немецким ученым Эрихом Хюккелем в 1923-1925 гг.).
Основные положения:
1. Электролиты в растворе полностью диссоциируют на ионы
2. Концентрация молекул электролита не превышает 0,01 моль/л (растворы разбавлены)
3. Каждый среднестатистический ион окружен ионами противоположного
знака, с образованием окружающей его ионной атмосферы.
Это межионное взаимодействие приводит к тому, что движение
ионов затруднено. Снижение подвижности ионов уменьшает
их степень участия в процессах, происходящих в растворе,
создаётся эффект снижения концентрации
электролита
Основные положения:
1. Электролиты в растворе полностью диссоциируют на ионы
2. Концентрация молекул электролита не превышает 0,01 моль/л (растворы разбавлены)
3. Каждый среднестатистический ион окружен ионами противоположного
знака, с образованием окружающей его ионной атмосферы.
Это межионное взаимодействие приводит к тому, что движение
ионов затруднено. Снижение подвижности ионов уменьшает
их степень участия в процессах, происходящих в растворе,
создаётся эффект снижения концентрации
электролита
Слайд 4Для оценки способности ионов к химическим реакциям в растворах сильных электролитов пользуются
Для оценки способности ионов к химическим реакциям в растворах сильных электролитов пользуются

понятием активность ионов.
Активность иона (а) –это его эффективная или условная концентрацию, соответственно которой он участвует в реакциях, происходящих в растворе электролита. Между активностью иона и его действительной концентрацией с существует зависимость:
a= f ∙ c
где f–коэффициент активности, который характеризует влияние электростатических сил на способность иона к химическим действиям. При
f< 1 движение иона в растворе замедлено.
Например, в 0,1 М растворе НСl активность иона Н+ равна 0,0814. Это означает, что в химических реакциях ион водорода действует так, как будто концентрация его составляет не 0,1 моль/л, а только 0,0814 моль/л. Тогда коэффициент активности водорода: f(H+)= 0,0814 / 0,1 = 0,814
На величину коэффициента активности оказывает влияние общая концентрация всех ионов в растворе. Это учитывают с помощью понятия ионной силы раствора электролита
Активность иона (а) –это его эффективная или условная концентрацию, соответственно которой он участвует в реакциях, происходящих в растворе электролита. Между активностью иона и его действительной концентрацией с существует зависимость:
a= f ∙ c
где f–коэффициент активности, который характеризует влияние электростатических сил на способность иона к химическим действиям. При
f< 1 движение иона в растворе замедлено.
Например, в 0,1 М растворе НСl активность иона Н+ равна 0,0814. Это означает, что в химических реакциях ион водорода действует так, как будто концентрация его составляет не 0,1 моль/л, а только 0,0814 моль/л. Тогда коэффициент активности водорода: f(H+)= 0,0814 / 0,1 = 0,814
На величину коэффициента активности оказывает влияние общая концентрация всех ионов в растворе. Это учитывают с помощью понятия ионной силы раствора электролита
Слайд 5Ионная сила раствора (I) –величина, характеризующая интенсивность электростатического поля всех ионов в
Ионная сила раствора (I) –величина, характеризующая интенсивность электростатического поля всех ионов в

растворе
Равна полусумме произведений молярной концентрации каждого иона на квадрат его заряда:
I = Σ (Cizi2)
где I –ионная сила раствора, ci–молярная концентрация того или иного иона в растворе, zi–заряд иона.
Пример: Рассчитаем ионную силу раствора, содержащего одновременно 0,01 моль ВаСl2 и 0,1 моль NaNO3 :
I = (С(Ва2+)∙22 + 2С(Сl– ) ∙ 12 + С(Na+ ) ∙ 12 + С(NO3 – ) ∙ 12 )
Считая, что ВаСl2 и NaNO3 как сильные электролиты диссоциированы в растворе полностью, можно находим значение I:
I = (0,01 ∙ 22 + 0,02 ∙ 12 + 0,1 ∙ 12 + 0,1 ∙ 12 ) = 0,13
С увеличением ионной силы растворов коэффициенты активности ионов уменьшаются. Однако в достаточно разбавленных растворах с одинаковой ионной силой у равнозарядных ионов они имеют близкие значения.
Равна полусумме произведений молярной концентрации каждого иона на квадрат его заряда:
I = Σ (Cizi2)
где I –ионная сила раствора, ci–молярная концентрация того или иного иона в растворе, zi–заряд иона.
Пример: Рассчитаем ионную силу раствора, содержащего одновременно 0,01 моль ВаСl2 и 0,1 моль NaNO3 :
I = (С(Ва2+)∙22 + 2С(Сl– ) ∙ 12 + С(Na+ ) ∙ 12 + С(NO3 – ) ∙ 12 )
Считая, что ВаСl2 и NaNO3 как сильные электролиты диссоциированы в растворе полностью, можно находим значение I:
I = (0,01 ∙ 22 + 0,02 ∙ 12 + 0,1 ∙ 12 + 0,1 ∙ 12 ) = 0,13
С увеличением ионной силы растворов коэффициенты активности ионов уменьшаются. Однако в достаточно разбавленных растворах с одинаковой ионной силой у равнозарядных ионов они имеют близкие значения.
Слайд 6Электропроводность растворов электролитов
Электропроводность растворов электролитов

Слайд 7Способность растворов электролитов проводить электрический ток характеризуется электропроводностью (или обратной ей величиной
Способность растворов электролитов проводить электрический ток характеризуется электропроводностью (или обратной ей величиной

сопротивления). Электропроводность L рассчитывается по формуле:
L = 1/R = æ S/l,
где S – площадь поперечного сечения проводника; l – его длина; R – сопротивление; æ – удельная электропроводность.
Удельная электропроводность (æ) – это проводимость раствора, помещенного между электродами, расположенными на расстоянии 1 м, и площадью 1 м2, т.е. это электропроводность 1 м3 раствора.
Размерность удельной электропроводности – Ом -1∙м -1.
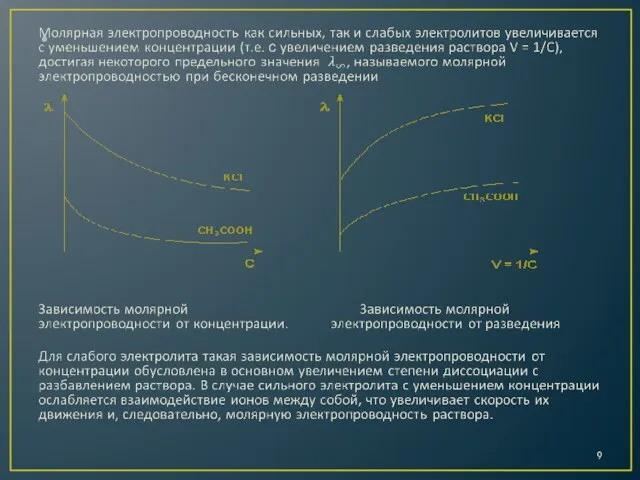
Для исследования поведения ионов в растворе гораздо удобнее пользоваться не удельной, а молярной электропроводностью (λ).
Молярной электропроводностью называется величина, измеряемая электрической проводимостью объема раствора, содержащего 1 моль вещества и заключенного между двумя параллельными электродами одинаковой формы, находящимися друг от друга на расстоянии 1 м. При этом площадь электродов должна быть такой, чтобы в объеме раствора между ними содержалась молярная масса (1 моль) вещества.
λ = æ/с
где с – молярная концентрация раствора, моль/л.
Размерность молярной электропроводности – м2/Ом ∙ моль или См ∙ м2/моль.
L = 1/R = æ S/l,
где S – площадь поперечного сечения проводника; l – его длина; R – сопротивление; æ – удельная электропроводность.
Удельная электропроводность (æ) – это проводимость раствора, помещенного между электродами, расположенными на расстоянии 1 м, и площадью 1 м2, т.е. это электропроводность 1 м3 раствора.
Размерность удельной электропроводности – Ом -1∙м -1.
Для исследования поведения ионов в растворе гораздо удобнее пользоваться не удельной, а молярной электропроводностью (λ).
Молярной электропроводностью называется величина, измеряемая электрической проводимостью объема раствора, содержащего 1 моль вещества и заключенного между двумя параллельными электродами одинаковой формы, находящимися друг от друга на расстоянии 1 м. При этом площадь электродов должна быть такой, чтобы в объеме раствора между ними содержалась молярная масса (1 моль) вещества.
λ = æ/с
где с – молярная концентрация раствора, моль/л.
Размерность молярной электропроводности – м2/Ом ∙ моль или См ∙ м2/моль.
Слайд 8Зависимость удельной электропроводности
электролитов от концентрации
(1 – H2SO4, 2 – KOH,
3
Зависимость удельной электропроводности
электролитов от концентрации
(1 – H2SO4, 2 – KOH,
3

– CH3COOH)
Слайд 12Практическое применение метода измерения электропроводности
Кондуктометрия- метод анализа, снованный на определении электропроводности жидких
Практическое применение метода измерения электропроводности
Кондуктометрия- метод анализа, снованный на определении электропроводности жидких

сред.
Измерение степени и константы диссоциации слабых электролитов
Измерение концентрации кислот и щелочей кондуктометрическим титрованием ( суть метода заключается в периодическом измерении электропроводности в процессе титрования. На основании полученных экспериментальных данных строят кривую зависимости: например электропроводности от количества щелочи, пошедшей на титрование)
Определение растворимости труднорастворимых солей
Определение влажности кондуктометрическим методом для измерения влажности зерна или почвы.
Измерение степени и константы диссоциации слабых электролитов
Измерение концентрации кислот и щелочей кондуктометрическим титрованием ( суть метода заключается в периодическом измерении электропроводности в процессе титрования. На основании полученных экспериментальных данных строят кривую зависимости: например электропроводности от количества щелочи, пошедшей на титрование)
Определение растворимости труднорастворимых солей
Определение влажности кондуктометрическим методом для измерения влажности зерна или почвы.
- Предыдущая
ЭлектрохимияСледующая -
Физическая и коллоидная химия


 The Nursing Process
The Nursing Process World.uz. Обучение за рубежом
World.uz. Обучение за рубежом Презентация на тему Удобрения как фактор жизни растения
Презентация на тему Удобрения как фактор жизни растения Проект и основные этапы его разработки
Проект и основные этапы его разработки Проект внедрения энергоэффективных технологий в сфере ЖКХ Новосибирской области
Проект внедрения энергоэффективных технологий в сфере ЖКХ Новосибирской области И. С. Тургенев стихотворение в прозе «Соперник» Амерханов Ярослав 10 Б
И. С. Тургенев стихотворение в прозе «Соперник» Амерханов Ярослав 10 Б Уроки обучения грамоте в букварный период в 1 классе СКОУ VIII вида
Уроки обучения грамоте в букварный период в 1 классе СКОУ VIII вида Художественная культура Древней Индии
Художественная культура Древней Индии Система технологического и промышленного видеонаблюдения
Система технологического и промышленного видеонаблюдения вар
вар 3.lekcija-IEKAISUMS
3.lekcija-IEKAISUMS день Матери
день Матери НАЦИОНАЛЬНЫЕ ПРАЗДНИКИ ЛИТВЫ
НАЦИОНАЛЬНЫЕ ПРАЗДНИКИ ЛИТВЫ  Презентация на тему Космический мусор
Презентация на тему Космический мусор «Моя математика» 1 класс
«Моя математика» 1 класс Пошив топа на лето
Пошив топа на лето Презентация на тему Городецкая роспись (2 класс)
Презентация на тему Городецкая роспись (2 класс) Gran o grande
Gran o grande Урок – путешествие по морю Знаний
Урок – путешествие по морю Знаний Инновационные разработки ЗАО «Алгонт»
Инновационные разработки ЗАО «Алгонт» Линеарные эскизы
Линеарные эскизы Экспертиза качества и безопасности товаров (прикладной бакалавриат)
Экспертиза качества и безопасности товаров (прикладной бакалавриат) Запуск презентациинажатием клавиши..... F5!Завершить презентацию нажатием клавиши..... ESC!
Запуск презентациинажатием клавиши..... F5!Завершить презентацию нажатием клавиши..... ESC! Этикет за столом
Этикет за столом Формирование делового центра комплекса «Аврора Парк»
Формирование делового центра комплекса «Аврора Парк» Задача про трест
Задача про трест ТЕНДЕНЦИИ ИЗМЕНЕНИЯ СИСТЕМЫ СОПРОВОЖДЕНИЯ ЛИЦ С ОВЗ В России
ТЕНДЕНЦИИ ИЗМЕНЕНИЯ СИСТЕМЫ СОПРОВОЖДЕНИЯ ЛИЦ С ОВЗ В России Презентация на тему Что такое Бенилюкс
Презентация на тему Что такое Бенилюкс