Содержание
- 2. До 1200 г. нашей эры человек был знаком с семью металлами:
- 3. Но наука никогда не стоит на месте: В середине XIX века было известно уже 63 химических
- 4. Классификация химических элементов на: металлы и неметаллы Якоб Йен Берцеллиус Общие свойства металлов: Пластичность – способность
- 5. Какими признаками обладают указанные вещества? Графит - углерод Кремний Йод Некоторые неметаллы обладают металлическими признаками Вывод:
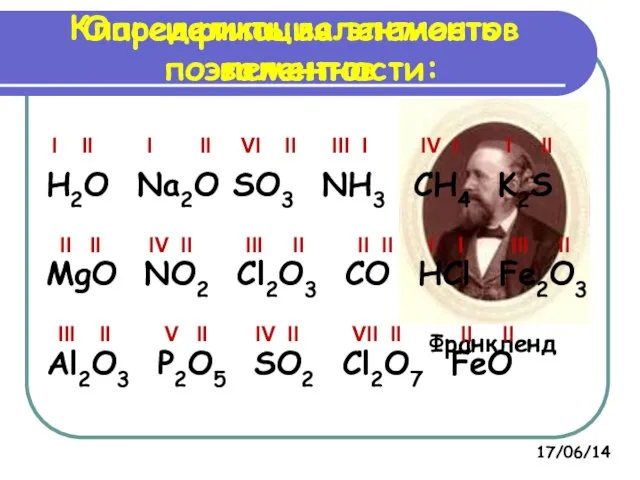
- 6. Классификация элементов по валентности: Франкленд I II I II VI II III I IV I I
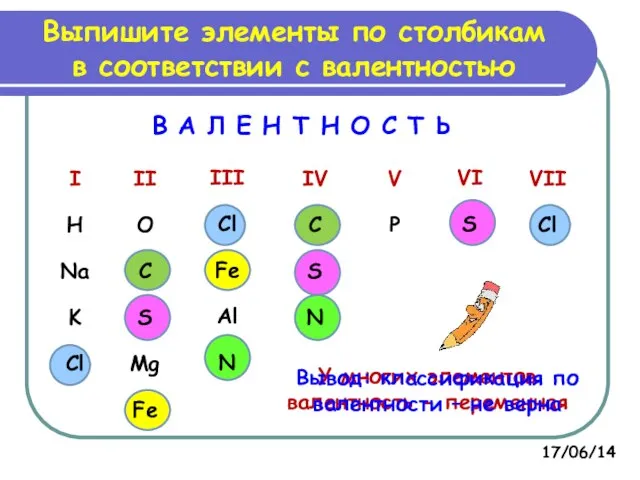
- 7. Выпишите элементы по столбикам в соответствии с валентностью В А Л Е Н Т Н О
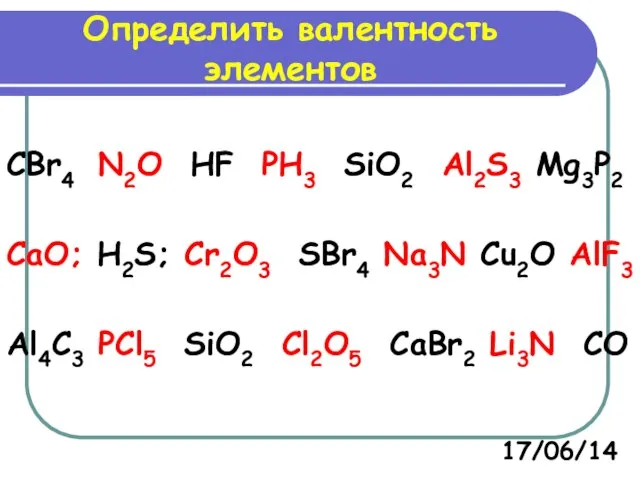
- 8. CBr4 N2O HF PH3 SiO2 Al2S3 Mg3P2 CaO; H2S; Cr2O3 SBr4 Na3N Cu2O AlF3 Al4C3 PCl5
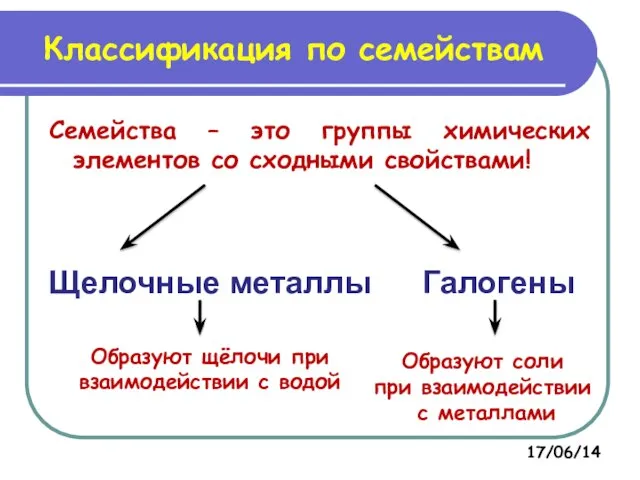
- 9. Классификация по семействам Семейства – это группы химических элементов со сходными свойствами! Щелочные металлы Галогены Образуют
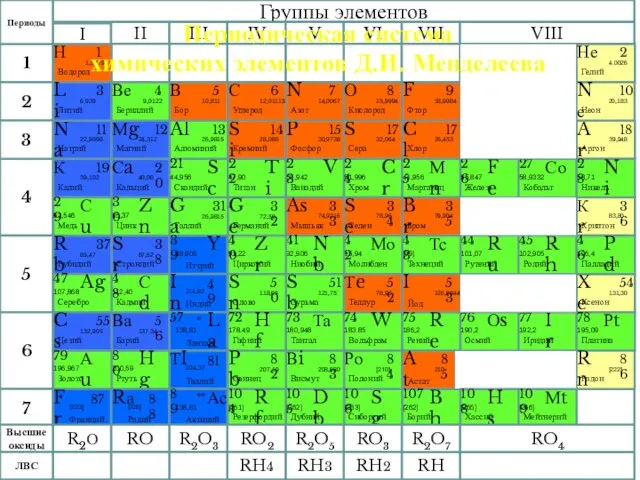
- 10. Периодическая система химических элементов Д.И. Менделеева
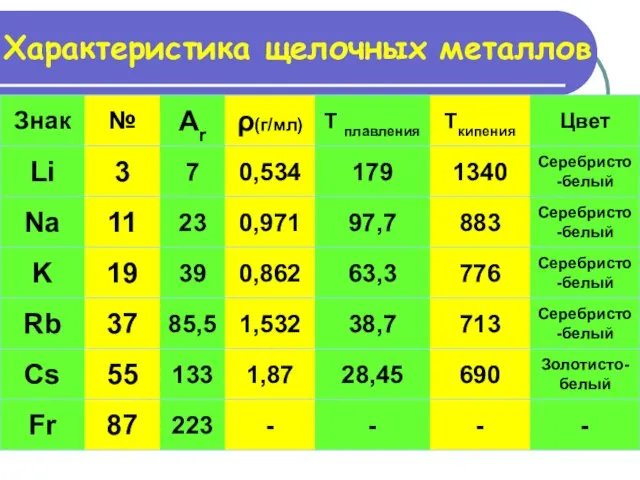
- 11. Характеристика щелочных металлов
- 12. Щелочные металлы – простые вещества литий натрий калий рубидий цезий
- 13. Na + H2O NaOH + H2 2 2 2 I I Взаимодействие щелочных металлов с
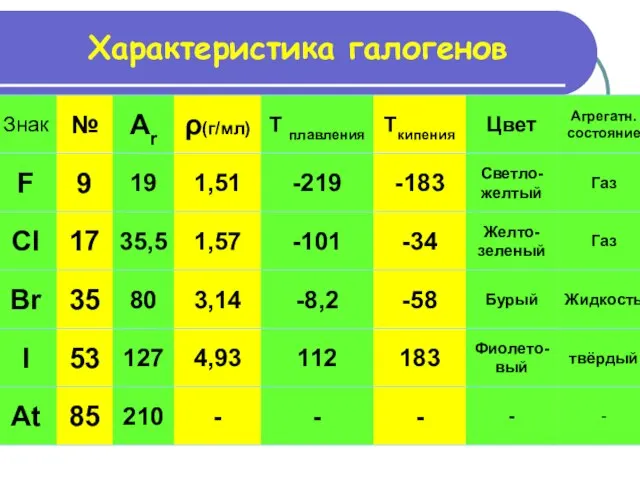
- 14. Характеристика галогенов
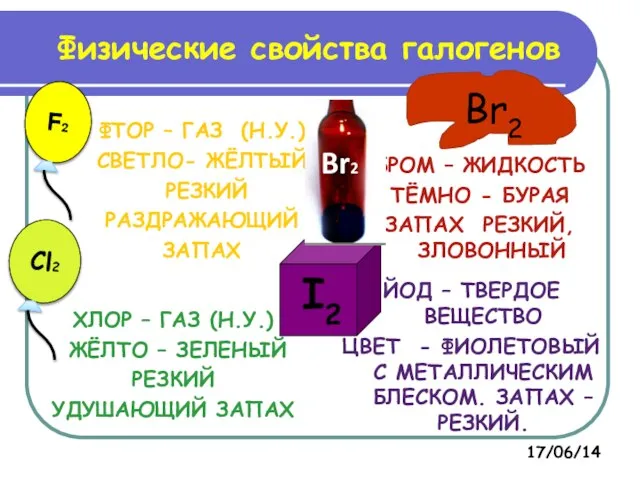
- 15. ФТОР – ГАЗ (Н.У.) СВЕТЛО- ЖЁЛТЫЙ РЕЗКИЙ РАЗДРАЖАЮЩИЙ ЗАПАХ БРОМ – ЖИДКОСТЬ ТЁМНО - БУРАЯ ЗАПАХ
- 16. Возгонка йода Возгонка – это переход вещества из твердого агрегатного состояния в газообразное, минуя жидкое.
- 17. Повторение: 1. Расставьте коэффициенты в следующих уравнениях реакций. Определите типы реакций: СаСО3 → СаО + CO2
- 19. Скачать презентацию








 Презентация на тему Родник
Презентация на тему Родник Система ценообразования стримеров
Система ценообразования стримеров Сочинение по картине Ивана Ивановича Шишкина Корабельная роща
Сочинение по картине Ивана Ивановича Шишкина Корабельная роща Быт и культура коренных народов Севера. 9 класс
Быт и культура коренных народов Севера. 9 класс Наши добрые дела
Наши добрые дела Технические средства и инженерно-технические системы обеспечения транспортной безопасности
Технические средства и инженерно-технические системы обеспечения транспортной безопасности  Экономика возобновляемой энергетики и ветроэнергетики
Экономика возобновляемой энергетики и ветроэнергетики Кинетика нелинейных процессов
Кинетика нелинейных процессов Презентация на тему Материальные и экономические трудности
Презентация на тему Материальные и экономические трудности Презентация на тему Устройства ввода информации
Презентация на тему Устройства ввода информации  Anne Bronte
Anne Bronte Основы алгоритмизации и программирования
Основы алгоритмизации и программирования Информационно-практический проектна тему:«Соблюдение Правил дорожного движения пешеходами».
Информационно-практический проектна тему:«Соблюдение Правил дорожного движения пешеходами». ЗАВИСИМОСТЬ МЕЖДУ СИНУСОМ, КОСИНУСОМ И ТАНГЕНСОМ ОДНОГО И ТОГО ЖЕ УГЛА
ЗАВИСИМОСТЬ МЕЖДУ СИНУСОМ, КОСИНУСОМ И ТАНГЕНСОМ ОДНОГО И ТОГО ЖЕ УГЛА Учет и хранение фондов музея образовательной организации
Учет и хранение фондов музея образовательной организации Ернест Хамингуей
Ернест Хамингуей  SMM. Галкина Любовь
SMM. Галкина Любовь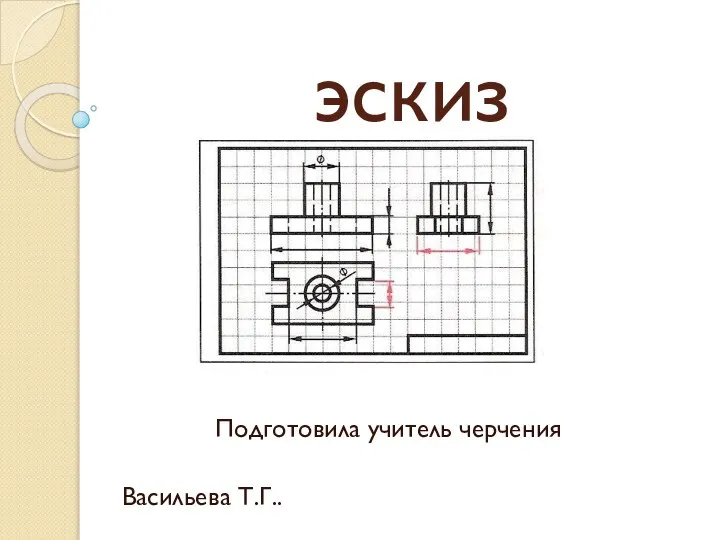 Эскиз
Эскиз Привлечение инвестиций
Привлечение инвестиций Методика анализа и оценки степени риска
Методика анализа и оценки степени риска AMPHIBIANS BULLFROG CROAK EGG FROG GILLS GUNGLE LEGS LEOPARD METAMORPHOSIS POND TADPOLE
AMPHIBIANS BULLFROG CROAK EGG FROG GILLS GUNGLE LEGS LEOPARD METAMORPHOSIS POND TADPOLE лекция 7 тема 1
лекция 7 тема 1 36f368566b7b47859a7e1559c9c90b96 (1)
36f368566b7b47859a7e1559c9c90b96 (1) Готовность ребёнка к школе
Готовность ребёнка к школе Презентация на тему Откуда взялся сфетофор
Презентация на тему Откуда взялся сфетофор Способы двигательной деятельности
Способы двигательной деятельности Сведения о морфемике и словообразовании
Сведения о морфемике и словообразовании В институтах Евросоюза официально равноправно используются 24 языка
В институтах Евросоюза официально равноправно используются 24 языка