Содержание
- 2. Стандарт планирования, проведения, выполнения мониторинга, аудита и документального оформления клинических испытаний, стандарт, который служит для общества
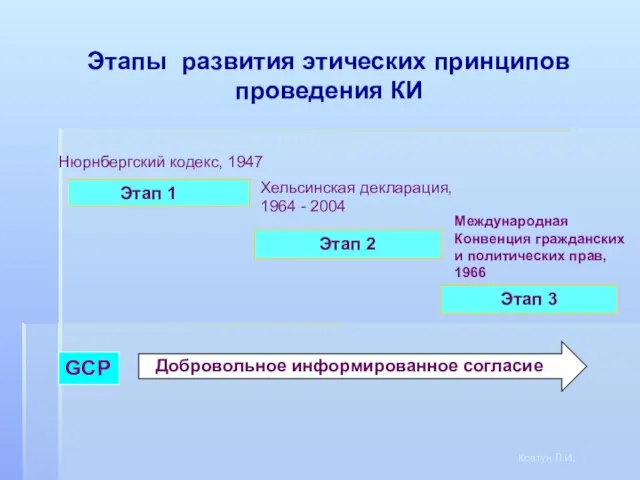
- 3. Этап 1 Нюрнбергский кодекс, 1947 Этап 2 Этап 3 GCP Этапы развития этических принципов проведения КИ
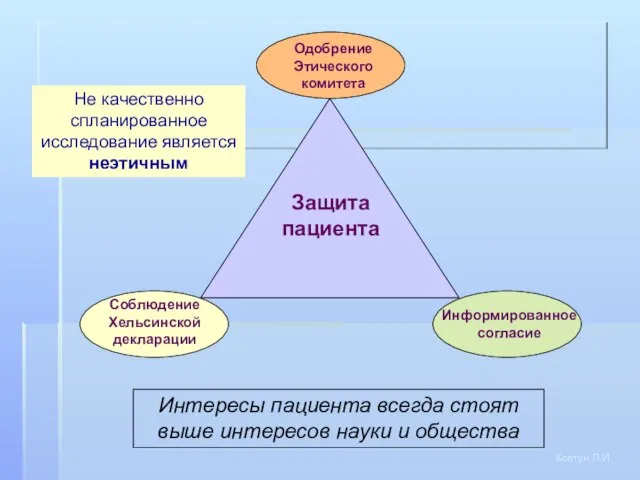
- 4. Защита пациента Одобрение Этического комитета Соблюдение Хельсинской декларации Информированное согласие Не качественно спланированное исследование является неэтичным
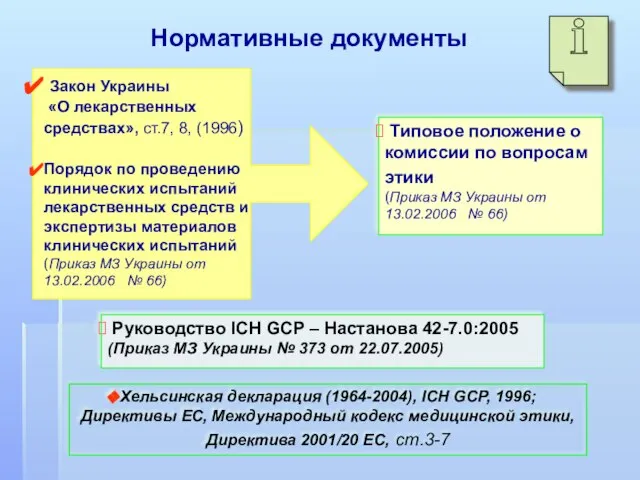
- 5. Нормативные документы Закон Украины «О лекарственных средствах», ст.7, 8, (1996) Порядок по проведению клинических испытаний лекарственных
- 6. Этический комитет: (Комиссия по вопросам этики) Independent Ethics Committee/IEC Institutional Review Board/IRB Ethical Review Committee/ERC который
- 7. Рекомендации к составу ЭК ЭК ведет список своих членов с указанием их квалификации Ковтун Л.И. Наличие:
- 8. Цели и задачи ЭК Гарантировать соблюдение этических норм при проведении КИ Защита прав и здоровья испытуемых
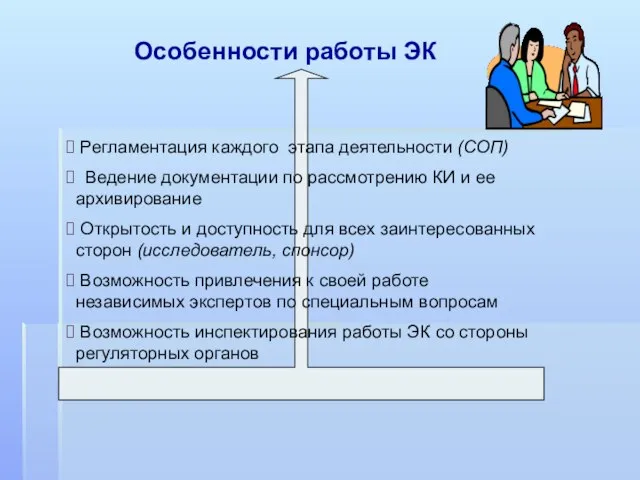
- 9. Особенности работы ЭК Регламентация каждого этапа деятельности (СОП) Ведение документации по рассмотрению КИ и ее архивирование
- 10. Перечень документов, предоставляемых в ЭК Заявка на рассмотрение материалов КИ Протокол КИ и поправки к нему
- 11. Рассмотрение материалов КИ Ковтун Л.И. Соответствие Протокола: целям и задачам КИ возможности получения результата при наименьшем
- 12. Рассмотрение материалов КИ Ковтун Л.И. ЭК должен убедиться: Данные не могут быть получены без привлечения людей
- 13. Принятие решения Решение принимается при наличии кворума Голосуют только те члены ЭК, которые рассматривали материалы КИ
- 14. Получение одобрения ЭК Получение информированного согласия испытуемого на участие в КИ Одобрение Условия для проведения КИ
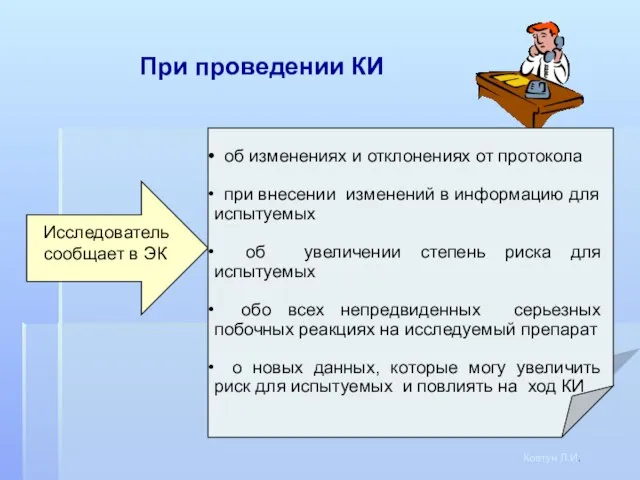
- 15. При проведении КИ Ковтун Л.И. Исследователь сообщает в ЭК об изменениях и отклонениях от протокола при
- 16. Информированное согласие - Ковтун Л.И. документально оформленное добровольное согласие испытуемого на участие в КИ после ознакомления
- 17. Испытуемый информирован: о целях исследования о методах исследования о ЛС и режиме лечения об имеющемся альтернативном
- 18. Испытуемому предоставляется: письменная информация и форма согласия после одобрения их ЭК время для обдумывания и принятия
- 19. Получение информированного согласия Процедура, с помощью которой испытуемый подтверждает свое добровольное согласие Ковтун Л.И. Исследователь не
- 20. Подписание ИС Испытуемый собственноручно подписывает и датирует форму ИС на участие в испытании на основе полученной
- 21. Следует принимать во внимание следующее: Если испытуемый не способен подписать информированное согласие, то согласие должен подписать
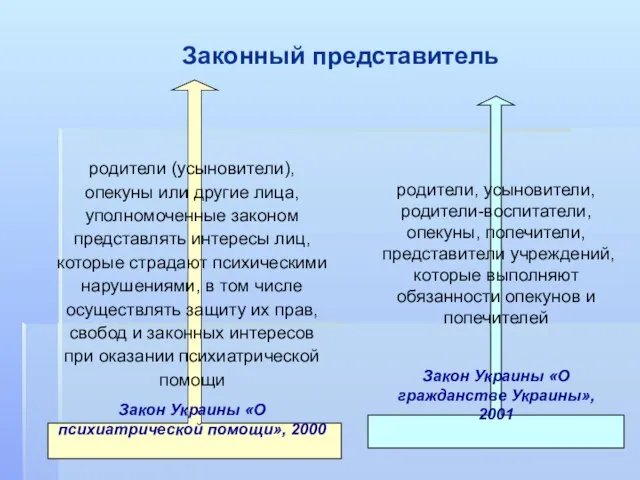
- 22. Законный представитель родители (усыновители), опекуны или другие лица, уполномоченные законом представлять интересы лиц, которые страдают психическими
- 23. Законный представитель подписывает ИС Несовершеннолетнего Лиц с психическими расстройствами Лиц, находящихся в неотложном состоянии Ковтун Л.И.
- 24. КИ с участием несовершеннолетних может проводиться если: Испытуемые получают непосредственную пользу от участия в КИ КИ
- 25. Получение информированного согласия у несовершеннолетнего Возраст, при котором ребенок может дать согласие, определяется ЭК и должен
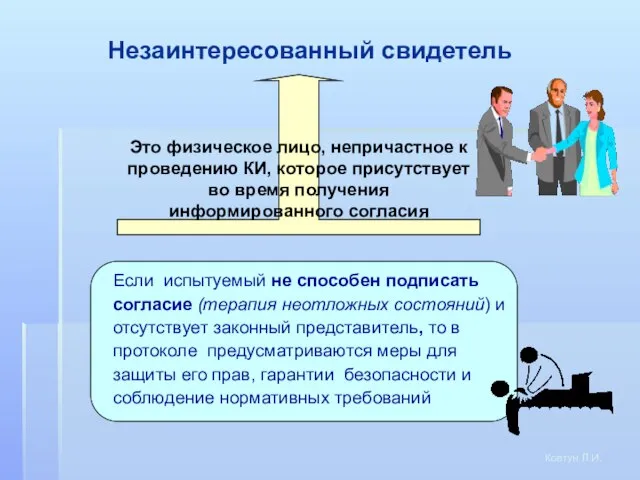
- 26. Незаинтересованный свидетель Ковтун Л.И. Это физическое лицо, непричастное к проведению КИ, которое присутствует во время получения
- 27. Уязвимые испытуемые Лица, чье добровольное согласие на участие в клиническом исследовании может быть результатом их чрезмерной
- 28. Уязвимые испытуемые: Пациенты, находящиеся в неотложном состоянии Больные, страдающие неизлечимыми заболеваниями Лица, содержащиеся в домах престарелых
- 29. продолжение Учащиеся медицинских, фармацевтических и стоматологических учебных заведений Персонал клиник и лабораторий Сотрудники фармацевтических компаний Служащие
- 31. Скачать презентацию




















 Наш кот
Наш кот Основные понятия теории информации
Основные понятия теории информации  Система правоотношений на транспорте
Система правоотношений на транспорте Тема 6. Социальные опасности и защита от них
Тема 6. Социальные опасности и защита от них Летняя кампания2011 года
Летняя кампания2011 года Баскетбо́л (англ. basket — корзина, ball — мяч)
Баскетбо́л (англ. basket — корзина, ball — мяч) Организация и проведение регионального этапа конкурса: разработка регионального плана мероприятий, формирование экспертной груп
Организация и проведение регионального этапа конкурса: разработка регионального плана мероприятий, формирование экспертной груп Светлые листья
Светлые листья Тренинг. Вводное занятие
Тренинг. Вводное занятие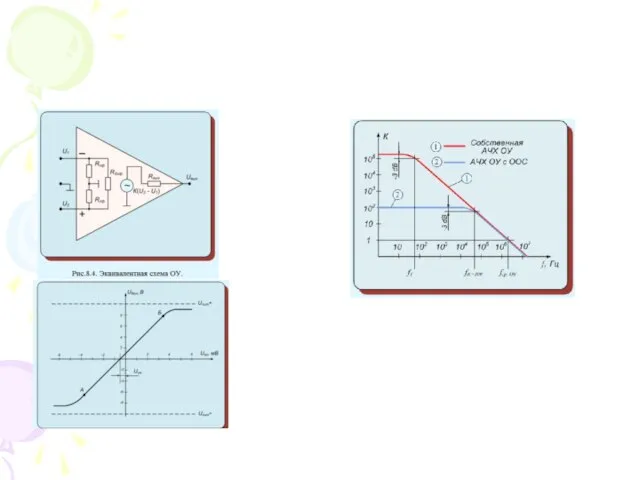 Операционные усилители
Операционные усилители Христианство и Ислам. История происхождения и основные характерные черты
Христианство и Ислам. История происхождения и основные характерные черты Лженаука в современном мире: медиасфера, высшее образование, школа
Лженаука в современном мире: медиасфера, высшее образование, школа Лыжная подготовка дошкольника
Лыжная подготовка дошкольника Электролиз
Электролиз Трихадеры в RAINBOW SIX
Трихадеры в RAINBOW SIX Одежда славян
Одежда славян Презентация на тему Как правильно переходить дорогу
Презентация на тему Как правильно переходить дорогу  Презентация на тему Антропогенез. Стадии антропогенеза
Презентация на тему Антропогенез. Стадии антропогенеза  Федеральный государственный образовательный стандарт
Федеральный государственный образовательный стандарт Старшая школа (2)
Старшая школа (2) Великие реформы 60-70 гг. XIX века
Великие реформы 60-70 гг. XIX века Опыт работы по теме:
Опыт работы по теме: Реализация музейно-образовательной программы Мы входим в мир прекрасного
Реализация музейно-образовательной программы Мы входим в мир прекрасного Россия в эпоху революций 1917 года и становления Советской власти
Россия в эпоху революций 1917 года и становления Советской власти ЛИТЕРАТУРА: В КАМНЕ И БРОНЗЕ
ЛИТЕРАТУРА: В КАМНЕ И БРОНЗЕ Раздельные пункты железных дорог. Раздел 6
Раздельные пункты железных дорог. Раздел 6 Характеристика видов рекламы
Характеристика видов рекламы Место риска в инвестировании капитала
Место риска в инвестировании капитала