Слайд 2Ферменты – это белковые молекулы, которые синтезируются живыми клетками. В каждой клетке

насчитывается более сотни различных ферментов. Роль ферментов в клетке колоссальна. С их помощью химические реакции идут с высокой скоростью, при температуре, подходящей для данного организма.
Слайд 3То есть ферменты – это биологические катализаторы, которые облегчают протекание химической реакции
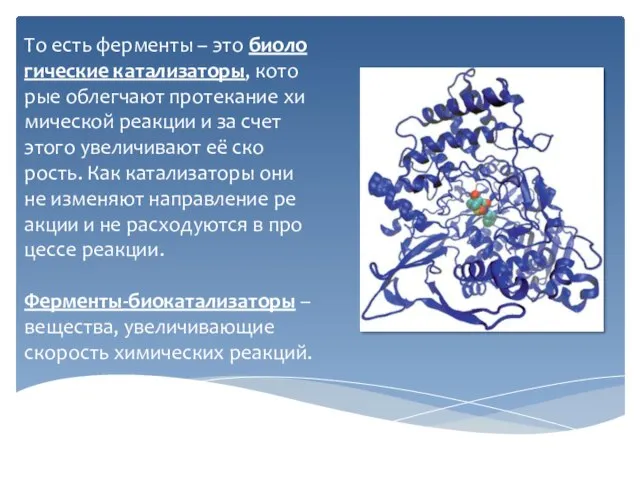
и за счет этого увеличивают её скорость. Как катализаторы они не изменяют направление реакции и не расходуются в процессе реакции.
Ферменты-биокатализаторы – вещества, увеличивающие скорость химических реакций.
Слайд 4Все ферменты – глобулярные белки с третичной или четвертичной структурой. Ферменты могут
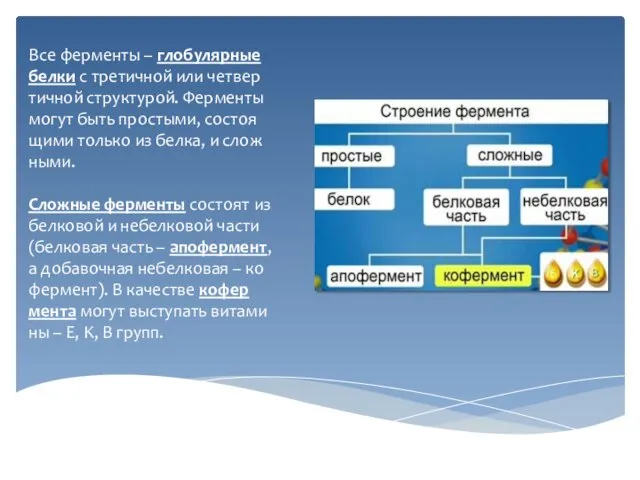
быть простыми, состоящими только из белка, и сложными.
Сложные ферменты состоят из белковой и небелковой части (белковая часть – апофермент, а добавочная небелковая – кофермент). В качестве кофермента могут выступать витамины – E, K, B групп.
Слайд 5Механизм действия ферментов
Фермент взаимодействует с субстратом и образует короткоживущий фермент-субстратный комплекс. По

завершении реакции, фермент-субстратный комплекс распадается на продукты и фермент. Фермент в итоге не изменяется: по окончании реакции он остается таким же, каким был до неё, и может теперь взаимодействовать с новой молекулой субстрата.
Слайд 6На рисунке представлен механизм работы фермента, в частности, образования пептидной связи между
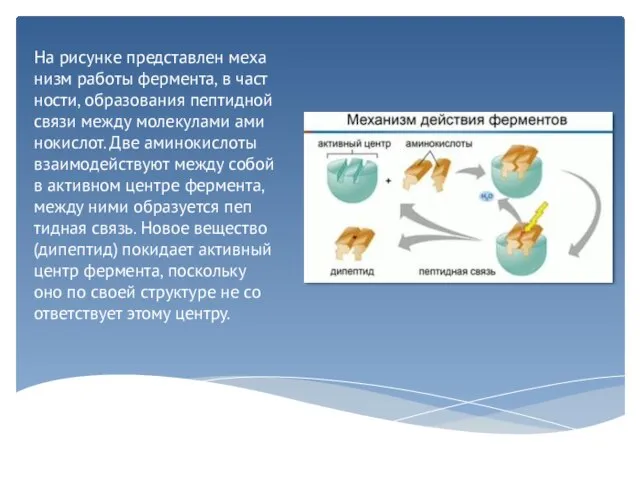
молекулами аминокислот. Две аминокислоты взаимодействуют между собой в активном центре фермента, между ними образуется пептидная связь. Новое вещество (дипептид) покидает активный центр фермента, поскольку оно по своей структуре не соответствует этому центру.
Слайд 7Особенностью ферментов является то, что они обладают высокой специфичностью, т. е. могут

ускорять только одну реакцию или реакции одного типа.
В 1890 году Э. Г. Фишер предположил, что эта специфичность обусловлена особой формой молекулы фермента, которая точно соответствует форме молекулы субстрата. Эта гипотеза получила название «ключа и замка», где ключ сравнивается с субстратом, а замок – с ферментом. Гипотеза гласит: субстрат подходит к ферменту, как ключ подходит к замку. Избирательность действия фермента связана со строением его активного центра.
Слайд 8Активность ферментов
В первую очередь, на активность фермента влияет температура. С повышением температуры

скорость химической реакции возрастает. Увеличивается скорость молекул, у них появляется больше шансов столкнуться друг с другом. Следовательно, увеличивается вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую активность фермента – оптимальная.
Слайд 9За пределами оптимальной температуры скорость реакции снижается вследствие денатурации белков. Когда температура
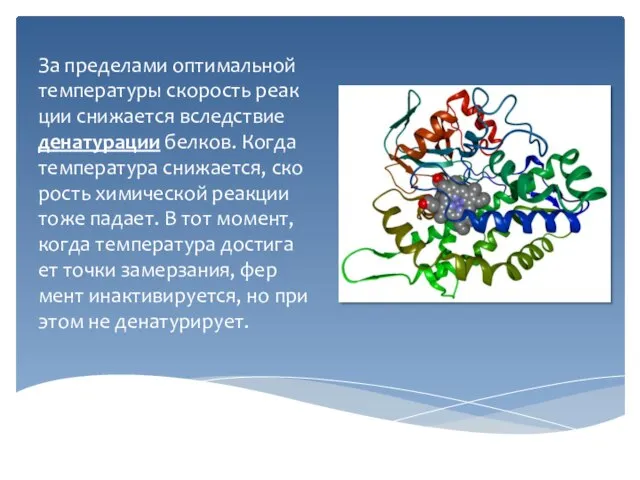
снижается, скорость химической реакции тоже падает. В тот момент, когда температура достигает точки замерзания, фермент инактивируется, но при этом не денатурирует.
Слайд 10Кроме этого, активность ферментов зависит ещё от pH среды (кислотности – то

есть показателя концентрации ионов водорода).
В большинстве случаев, ферменты работают при нейтральном pH, т. е. при pH около 7. Но существуют ферменты, которые работают либо в кислой и сильнокислой, либо в щелочной и сильнощелочной среде.
Слайд 11Классификация ферментов
В 1961 году была предложена систематическая классификация ферментов на 6 групп.

Но названия ферментов оказались очень длинными и трудными в произношении, поэтому ферменты принято сейчас именовать с помощью рабочих названий.
Слайд 12Рабочее название состоит из названия субстрата, на который действует фермент, и окончания

«аза». Например, если вещество — лактоза, то есть молочный сахар, то лактаза – это фермент который его преобразует. Если сахароза (обыкновенный сахар), то фермент, который его расщепляет, – сахараза. Соответственно, ферменты, которые расщепляют протеины, носят название протеиназы.
Слайд 13Значение ферментов
Ферменты применяются практически во всех областях человеческой деятельности, и такое широкое
применение, в первую очередь, связано с тем, что они сохраняют свои уникальные свойства вне живых клеток.
Слайд 14Ферменты групп амилаз, протеаз и липаз применяются в медицине. Они расщепляют крахмал,

белки и жиры. Все эти ферменты, как правило, входят в состав комбинированных препаратов, таких как фестал и панзинорм, и используются, в первую очередь, для лечения заболеваний желудочно-кишечного тракта.
Слайд 15Ферменты применяют для растворения тромбов в кровеносных сосудах, при лечении гнойных ран.
Особое

место занимает энзимотерапия при лечении онкологических заболеваний.
Такие ферменты как амилаза расщепляют крахмал и поэтому широко используются в пищевой промышленности. В пищевой промышленности используется протеиназа, расщепляющая белки, и липазы, расщепляющие жиры. Ферменты амилазы используются в хлебопечении, виноделии и пивоварении.














 Философия Общая характеристика предмета
Философия Общая характеристика предмета Программа Microsoft PowerPoint
Программа Microsoft PowerPoint Цветущие дворики села. Фотовыставка
Цветущие дворики села. Фотовыставка Источники трудового права
Источники трудового права Социальная защита несовершеннолетних в РФ
Социальная защита несовершеннолетних в РФ Выражение отношения к окружающему миру через изображение животных
Выражение отношения к окружающему миру через изображение животных Гиппиус
Гиппиус Методика проведения игровых программ: практические советы и рекомендации
Методика проведения игровых программ: практические советы и рекомендации Презентация1
Презентация1 Мировая религия Буддизм 7 класс
Мировая религия Буддизм 7 класс Османская империя в XIV-XVI веках
Османская империя в XIV-XVI веках Открытое акционерное общество «Сибвзрывкомплект»
Открытое акционерное общество «Сибвзрывкомплект» SQA DAYS 9:Опыт создания своей QA компании
SQA DAYS 9:Опыт создания своей QA компании БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Выпускная работа по«Основам информационных технологий» Минск – 2010 г.
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Выпускная работа по«Основам информационных технологий» Минск – 2010 г. НИР-2008
НИР-2008 Речевые ошибки
Речевые ошибки Силикатная промышленность
Силикатная промышленность Криптовалюты. Блокчейн и биткойн
Криптовалюты. Блокчейн и биткойн Отчет о проделанной работе ЮАО. Бизнес разведка Тайм кафе
Отчет о проделанной работе ЮАО. Бизнес разведка Тайм кафе 1 класс
1 класс Бизнес-план антикафе Час за минуту
Бизнес-план антикафе Час за минуту ГК РФ Статья 87. Основные положения об обществе с ограниченной ответственностью
ГК РФ Статья 87. Основные положения об обществе с ограниченной ответственностью Повторение
Повторение Основы коммерческой деятельности
Основы коммерческой деятельности Алкоголь
Алкоголь Жизненный цикл проекта. Инициация
Жизненный цикл проекта. Инициация Потестарно-политические институты обских угров в дореволюционной России и в советское время (Никифорова И.М.)
Потестарно-политические институты обских угров в дореволюционной России и в советское время (Никифорова И.М.) Принятие управленческих решений
Принятие управленческих решений