Содержание
- 2. Физические свойства алкинов С2 – С4 газы С5 – С 15 жидкости Свыше С16 – твердые
- 3. Химические свойства алкинов 1. Реакции присоединения АЕ Н.Б.Давыдова, учитель химии МБОУ "Вадская СОШ"
- 4. Химические свойства алкинов 1. Реакции присоединения АЕ а) Гидрирование(+Н2) в 2 стадии: Н.Б.Давыдова, учитель химии МБОУ
- 5. 1. Реакции присоединения АЕ б) Галогенирование (+Г2) в 2 стадии: Качественная реакция на алкины – бромная
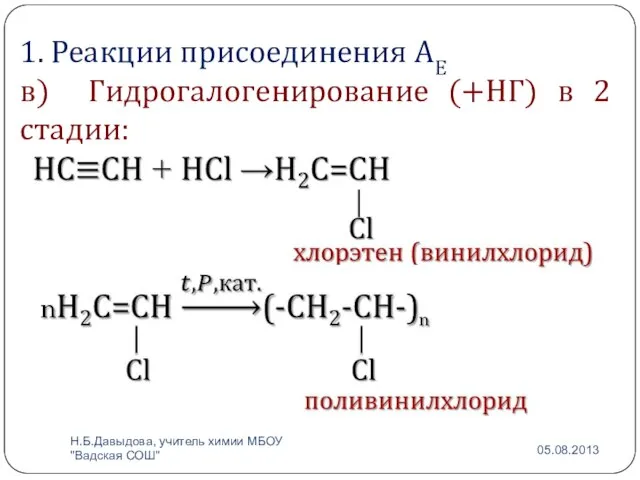
- 6. 1. Реакции присоединения АЕ в) Гидрогалогенирование (+НГ) в 2 стадии: Н.Б.Давыдова, учитель химии МБОУ "Вадская СОШ"
- 7. Применение поливинилхлорида: Изоляция для проводов, изоляционная лента, искусственная кожа, плащи, кленка. Н.Б.Давыдова, учитель химии МБОУ "Вадская
- 8. Присоединение НГ к несимметричным алкинам (по правилу Марковникова) МАРКОВНИКОВ Владимир Васильевич Н.Б.Давыдова, учитель химии МБОУ "Вадская
- 9. МАРКОВНИКОВ Владимир Васильевич (13 декабря 1837—29 января 1904) — русский химик, основатель научной школы. Развивая теорию
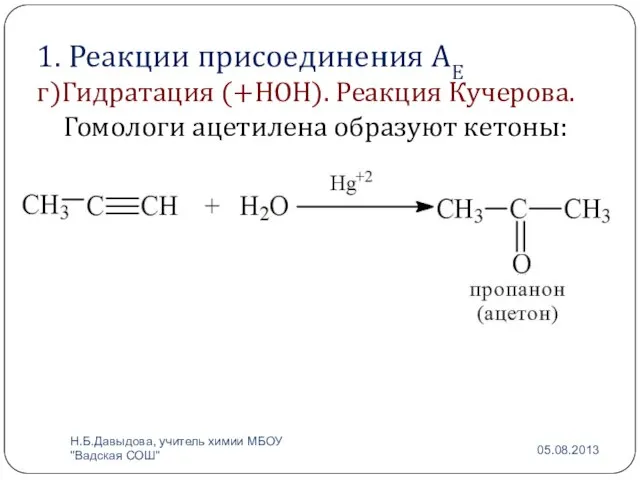
- 10. 1. Реакции присоединения АЕ г)Гидратация (+НОН). Реакция Кучерова. КУЧЕРОВ Михаил Григорьевич Правило Эльтекова: Спирты, содержащие гидроксо-группу
- 11. КУЧЕРОВ Михаил Григорьевич (3 июня1850 – 26 июня 1911). Русский химик-органик. Основные работы посвящены развитию органического
- 12. 1. Реакции присоединения АЕ г)Гидратация (+НОН). Реакция Кучерова. Гомологи ацетилена образуют кетоны: Н.Б.Давыдова, учитель химии МБОУ
- 13. Опыт. Горение ацетилена Ацетилен образует с воздухом и кислородом взрывоопасные смеси. Опыт . Взрыв смеси ацетилена
- 14. 2. Реакции окисления. а) Окисление раствором водным раствором перманганата калия (качественная реакция). В нейтральной и слабощелочной
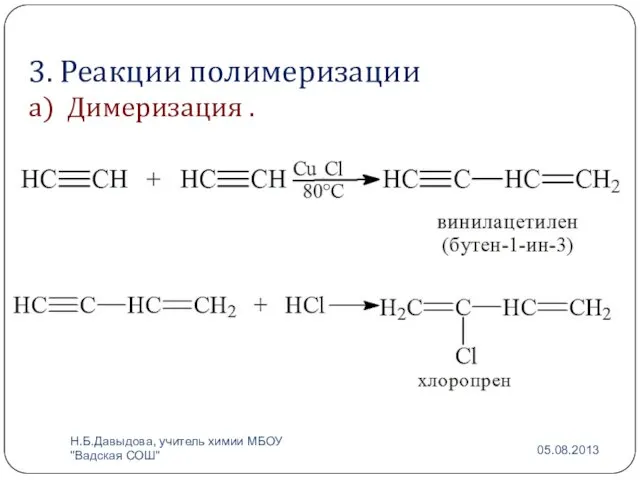
- 15. 3. Реакции полимеризации а) Димеризация . Н.Б.Давыдова, учитель химии МБОУ "Вадская СОШ"
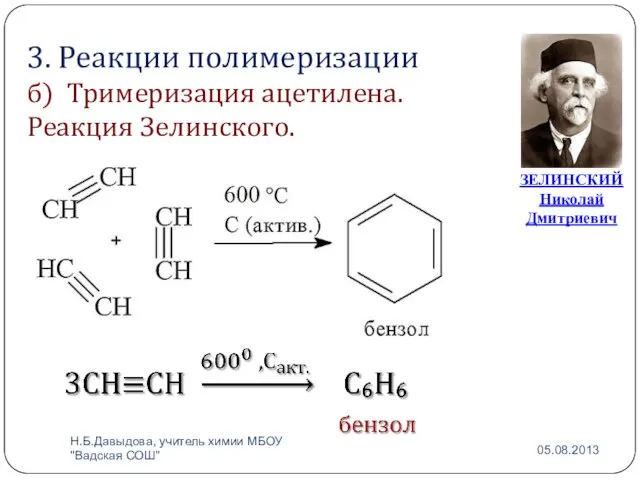
- 16. 3. Реакции полимеризации б) Тримеризация ацетилена. Реакция Зелинского. ЗЕЛИНСКИЙ Николай Дмитриевич Н.Б.Давыдова, учитель химии МБОУ "Вадская
- 17. Николай Дмитриевич Зелинский (25 января 1861 — 31 июля 1953) — замечательный русский химик, основоположник учения
- 18. 4. Реакции замещения (кислотные свойства) HC≡CH + Ag2O → AgC≡CAg↓+ H2O амм. р-р ацетиленид серебра, белый
- 19. ТРЕНАЖЁРЫ: Закрепление материала Типы химических реакций, характерные для алкинов Уравнения реакций, характеризующие химические свойства ацетилена Химические
- 20. ПОДГОТОВКА К ЕГЭ: Закрепление материала Базовый уровень сложности 1. При гидратации ацетилена образуется 1) этанол 2)
- 21. ПОДГОТОВКА К ЕГЭ: Базовый уровень сложности 5. Пропин можно отличить от пропена с помощью 1) водного
- 22. Повышенный уровень сложности 8. Бутин-1 способен реагировать с 1) натрием 4) кислородом 2) гидроксидом натрия 5)
- 23. Домашнее задание: Учебник: Кузнецова Н.Е., Гара Н.Н. Титова И.М.; под ред. Н. Е. Кузнецовой. Химия: профильный
- 25. Скачать презентацию


















 Материя 2. Два способа существования материи
Материя 2. Два способа существования материи  История развития компьютерной техники
История развития компьютерной техники Магазин ООО Тринити-К
Магазин ООО Тринити-К Ак шараптар
Ак шараптар Проектирование сухого отсека ракеты-носителя из композиционных материалов с применением численной оптимизации
Проектирование сухого отсека ракеты-носителя из композиционных материалов с применением численной оптимизации Оборотный капитал корпорации
Оборотный капитал корпорации  Визуализация процесса распространения трещин в хрупких анизотропных материалах при компьютерном моделировании
Визуализация процесса распространения трещин в хрупких анизотропных материалах при компьютерном моделировании MADHU JAYANTI INTERNATIONAL LTD.
MADHU JAYANTI INTERNATIONAL LTD. Презентация на тему Царство Животные Тип Членистоногие Подтип Хелицеровые Класс Паукообразные
Презентация на тему Царство Животные Тип Членистоногие Подтип Хелицеровые Класс Паукообразные  Презентація1
Презентація1 Нанесение размеров с учётом формы предмета
Нанесение размеров с учётом формы предмета Хакасская национальная одежда
Хакасская национальная одежда Урок обучения грамоте
Урок обучения грамоте Компьютеры будущего
Компьютеры будущего Текстовые задачи как средство развития творческих способностей младших школьников
Текстовые задачи как средство развития творческих способностей младших школьников Презентация на тему Киевская земля (княжество)
Презентация на тему Киевская земля (княжество)  Деление и дроби (5 класс)
Деление и дроби (5 класс) Защита имущественных прав несовершеннолетних
Защита имущественных прав несовершеннолетних Петроград- Ленинград в годы НЭПа. - презентация
Петроград- Ленинград в годы НЭПа. - презентация Правописание падежных окончаний имён прилагательных
Правописание падежных окончаний имён прилагательных 707d6447bc8d447ca089a52f336ece7d
707d6447bc8d447ca089a52f336ece7d Пример презентации политики Хрущева
Пример презентации политики Хрущева НАЦИОНАЛЬНЫЙ ПАРК «ХВАЛЫНСКИЙ»
НАЦИОНАЛЬНЫЙ ПАРК «ХВАЛЫНСКИЙ» Кукла-оберег На удачу
Кукла-оберег На удачу Линейный алгоритм
Линейный алгоритм Презентация на тему Биография Ивана Сергеевича Тургенева
Презентация на тему Биография Ивана Сергеевича Тургенева Международный день отказа от курения
Международный день отказа от курения Презентация на тему Влияние человека на животных
Презентация на тему Влияние человека на животных