Содержание
- 2. Разработка лекарств Доклинические исследования I фаза клинических испытаний • II фаза клинических испытаний III фаза клинических
- 3. На международной арене клинические исследования дают шанс нашей стране заработать положительный имидж в мировых медицинских и
- 4. Основные принципы проведения КИ
- 5. Зарубежные инвестиции в сектор здравоохранения со стороны фармацевтических компаний позволяют улучшить торговый баланс страны в целом,
- 6. Условия проведения КИ в Украине
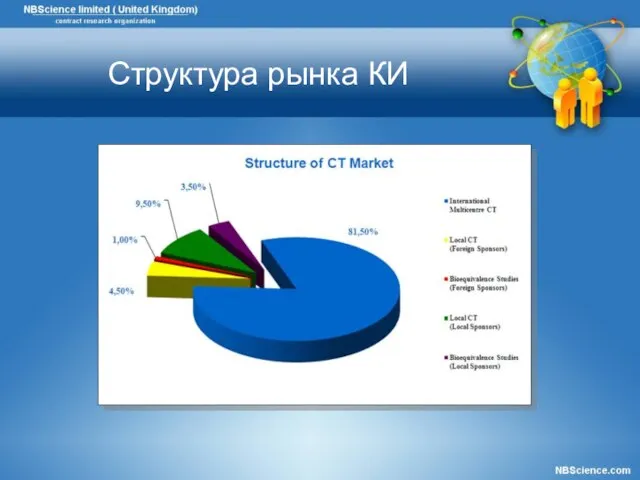
- 7. Структура рынка КИ
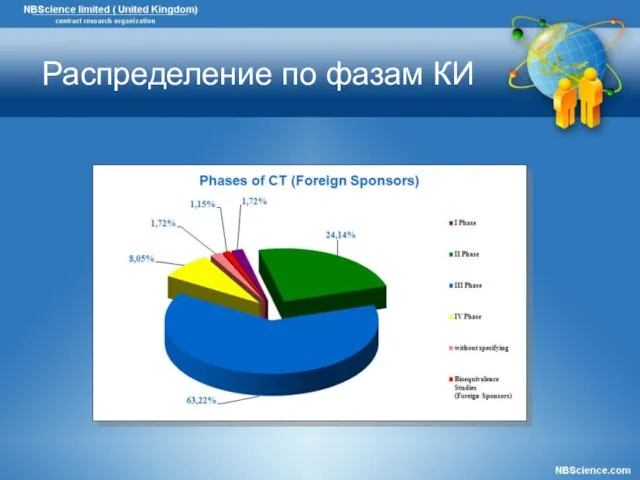
- 8. Распределение по фазам КИ
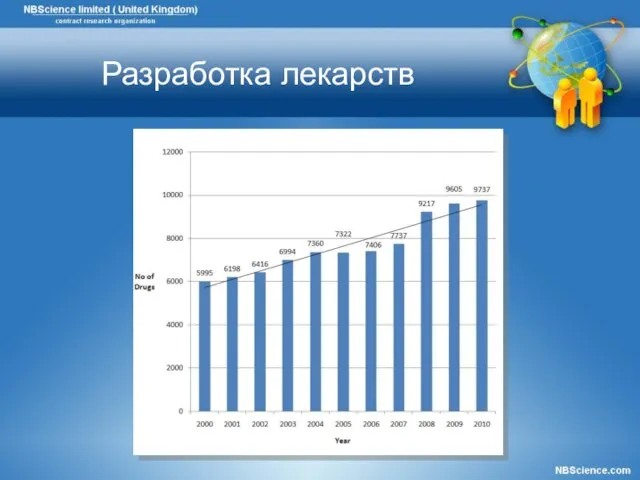
- 9. Разработка лекарств
- 10. Разработка лекарств,затраты
- 11. Структура рынка КИ
- 12. Исследователь
- 13. 1 2 3 ИССЛЕДОВАТЕЛЬ ПАЦИЕНТ CRO – СПОНСОР РЕГУЛЯТОРНЫЙ ОРГАН ОСНОВНЫЕ ИГРОКИ
- 14. Регистры клинических исследований
- 15. Начиная с 1991 г. регулярно проводятся Международные конференции по гармонизации (ICH), в ходе которых согласовываются различные
- 16. Хельсинская декларация Этические принципы проведения медицинских исследований с участием людей в качестве субъектов исследования Принята на
- 17. Министерство здравоохранения Японии Европейская федерация ассоциаций фармацевтической промышленности комиссия Евросоюза Ассоциация фармацевтических производителей Японии FDA США
- 18. А Б В Законодательство ЕС:
- 19. Г Д Е Законодательство ЕС: Note for Guidance on Structure and Content of Clinical Study Reports
- 20. В области КИ украинская нормативная база максимально соответствует европейской, а наши КБ и исследователи ежегодно участвуют
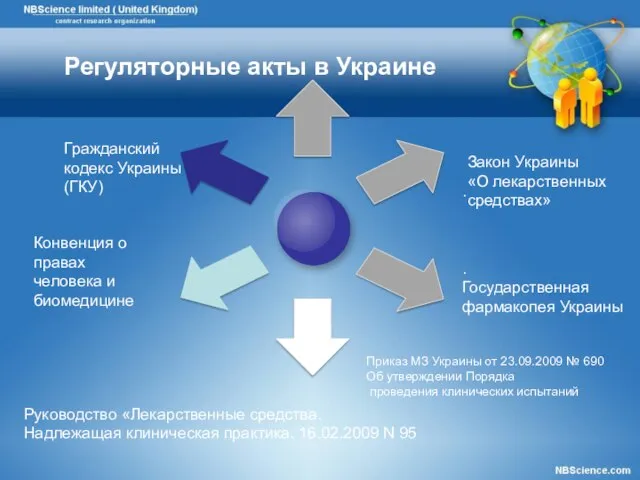
- 21. Конвенция о правах человека и биомедицине Гражданский кодекс Украины (ГКУ) . . Государственная фармакопея Украины Закон
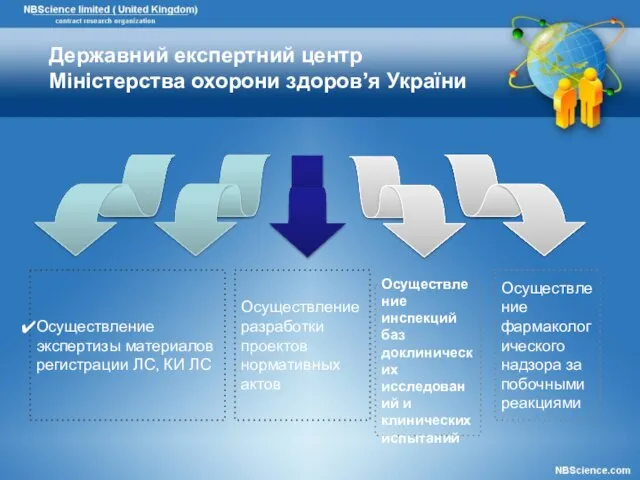
- 22. Осуществление экспертизы материалов регистрации ЛС, КИ ЛС Осуществление разработки проектов нормативных актов Осуществление инспекций баз доклинических
- 23. По данным Государственного фармцентра, за последние три года в список запрещенных или частично запрещенных попали Эуфилин,Ксеникал
- 24. Відповідно до статті 17 Закону України "Про лікарські засоби", абзацу чотирнадцятого підпункту 8.8 підпункту 8 пункту
- 25. Настанова "Лікарські засоби. Належна виробнича практика. СТ-Н МОЗУ 42-4.0:2008", затверджена наказом МОЗ від 16.02.2009 N 95.
- 26. НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА - GCP GCP - международный этический и научный стандарт качества планирования и проведения
- 27. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.1 Клинические исследования должны проводиться в соответствии с этическими принципами, заложенными Хельсинкской
- 28. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.2 До начала исследования должна быть проведена оценка соотношения прогнозируемого риска и
- 29. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.3 Права, безопасность и благополучие субъекта исследования имеют первостепенное значение и должны
- 30. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.4 Имеющаяся информация (неклиническая и клиническая) об исследуемом продукте должна быть достаточной
- 31. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.5 Клинические исследования должны отвечать научным требованиям и быть четко и подробно
- 32. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.6 Клиническое исследование должно проводиться в соответствии с протоколом, утвержденным Экспертным советом
- 33. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.7 Ответственность за оказываемую субъекту медицинскую помощь и принятие решений медицинского характера
- 34. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.8 Все привлекаемые к проведению исследования лица должны иметь соответствующие образование, подготовку
- 35. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.9 Добровольное информированное согласие должно быть получено у каждого субъекта до его
- 36. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.10 Вся полученная в клиническом исследовании информация должна регистрироваться, передаваться и храниться
- 37. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.11 Конфиденциальность записей, позволяющих идентифицировать субъектов исследования, должна быть обеспечена с соблюдением
- 38. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.12 Производство и хранение исследуемых продуктов, а также обращение с ними должны
- 39. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ 2.13 Для обеспечения качества каждого аспекта исследования должны быть внедрены системы и
- 40. ИНФОРМИРОВАННОЕ СОГЛАСИЕ 4.8.1 При получении и документальном оформлении информированного согласия исследователь должен соблюдать нормативные требования, придерживаться
- 41. ИНФОРМИРОВАННОЕ СОГЛАСИЕ 4.8.2 Письменная форма информированного согласия и любые другие письменные материалы, предоставляемые субъектам, должны дополняться/исправляться
- 42. ИНФОРМИРОВАННОЕ СОГЛАСИЕ Любая дополненная/исправленная письменная форма информированного согласия и любые другие дополненные/исправленные письменные материалы, предоставляемые субъектам,
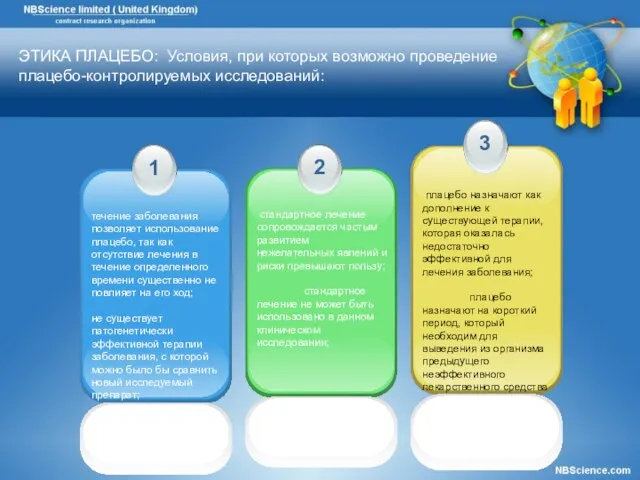
- 43. ЭТИКА ПЛАЦЕБО: Условия, при которых возможно проведение плацебо-контролируемых исследований:
- 44. Наказ МОЗ України №690 від 23 вересня 2009р. "Про затвердження Порядку проведення клінічних випробувань лікарських засобів
- 45. Приказом № 690 даны определения главному исследователю Так, исследователь — врач, имеющий достаточную профессиональную подготовку и
- 46. В письменной и устной информации, предоставляемой пациенту или его законному представителю, должно быть указано следующее: исследовательский
- 47. приказом № 690 определено, что испытание может проводиться в случае, когда обеспечено страхование ответственности на случай
- 48. Наказ МОЗ України № 944 від 14 грудня 2009р. "Про затвердження Порядку проведення доклінічного вивчення лікарських
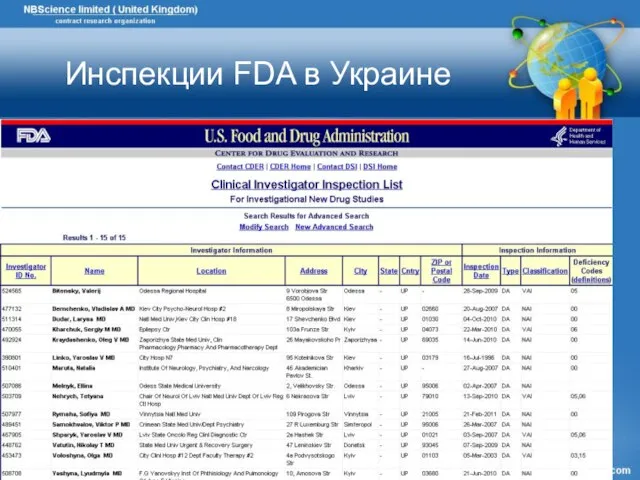
- 49. Инспекции FDA в Украине
- 50. Инспекции EMEA в Украине
- 52. Скачать презентацию








































 Кукурузные хлопья. Здоровые завтраки
Кукурузные хлопья. Здоровые завтраки Городской гонкурс плакатов и листовок
Городской гонкурс плакатов и листовок ГОУ ЦЕНТР ДИАГНОСТИКИ И КОНСУЛЬТИРОВАНИЯ«УЧАСТИЕ»
ГОУ ЦЕНТР ДИАГНОСТИКИ И КОНСУЛЬТИРОВАНИЯ«УЧАСТИЕ» ПРЕЗЕНТАЦИЯ БИЗНЕС-ПЛАНА СОЗДАНИЯ АГРОПРОМЫШЛЕННОГО ХОЛДИНГАООО «ЛЮБИМСКАЯ БИОРАПСОВАЯ КОМПАНИЯ»
ПРЕЗЕНТАЦИЯ БИЗНЕС-ПЛАНА СОЗДАНИЯ АГРОПРОМЫШЛЕННОГО ХОЛДИНГАООО «ЛЮБИМСКАЯ БИОРАПСОВАЯ КОМПАНИЯ» Презентация на тему: Вставь пропущенную букву
Презентация на тему: Вставь пропущенную букву Исследовательская работа«Определение содержания нитратов в овощах, выращенных на дачном участке и китайского происхождения»
Исследовательская работа«Определение содержания нитратов в овощах, выращенных на дачном участке и китайского происхождения» Шедевры Мировой архитектуры
Шедевры Мировой архитектуры Классическое международное право
Классическое международное право Система среднего профессионального образования Сибирского федерального округа
Система среднего профессионального образования Сибирского федерального округа Методологічний апарат логістики
Методологічний апарат логістики Работа и мощность электрического тока.
Работа и мощность электрического тока. Новый препарат для лечения остеоартроза
Новый препарат для лечения остеоартроза История денег. От монет до биткоина
История денег. От монет до биткоина Презентация на тему Аборты. О вреде абортов
Презентация на тему Аборты. О вреде абортов Стратегии развития и современные инструменты управления
Стратегии развития и современные инструменты управления Научно-исследовательская работа «Своеобразие воплощения образа золотого цвета в произведениях русских писателей и поэтов x׀x и xx веков в аспекте реализаций народно-сказочных традиций.» Выполнила: ученица 8 класса Дронова Анастасия
Научно-исследовательская работа «Своеобразие воплощения образа золотого цвета в произведениях русских писателей и поэтов x׀x и xx веков в аспекте реализаций народно-сказочных традиций.» Выполнила: ученица 8 класса Дронова Анастасия Наши достижения
Наши достижения Собственность. Организационно-правовые формы предприятий России
Собственность. Организационно-правовые формы предприятий России Александр Круглов. Графика
Александр Круглов. Графика История талисманов Олимпийских Игр
История талисманов Олимпийских Игр Элективный курс «Практическое право»
Элективный курс «Практическое право» Шедевры архитектуры Индии
Шедевры архитектуры Индии Память в системе познавательной деятельности
Память в системе познавательной деятельности Что такое ИТ-бюджет, система инвестиционных проектов или затратная часть бюджета организации?
Что такое ИТ-бюджет, система инвестиционных проектов или затратная часть бюджета организации? Оформление сайта
Оформление сайта Презентация на тему логарифмы и их свойства
Презентация на тему логарифмы и их свойства  Glowing stones
Glowing stones Удмуртские перепечи
Удмуртские перепечи