Содержание
- 2. Гидролиз – это реакции обменного Взаимодействия вещества с водой, приводящие к их разложению. Гидролизу подвергаются соединения
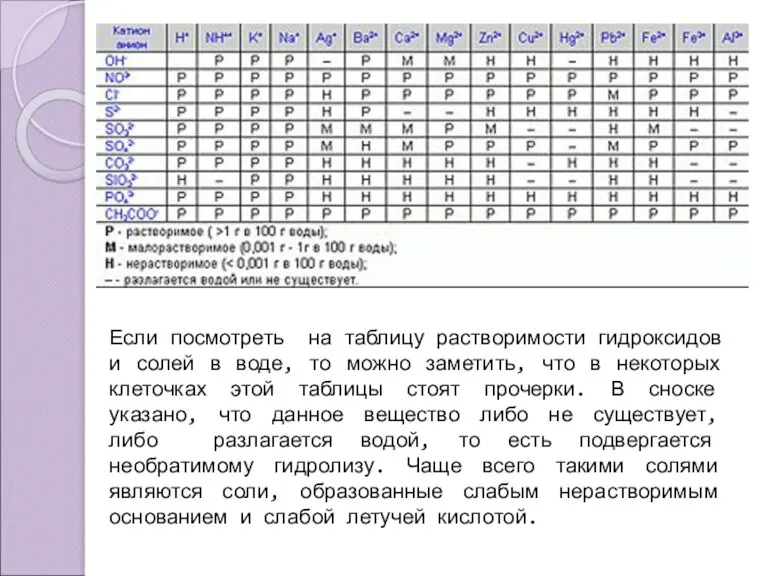
- 3. Если посмотреть на таблицу растворимости гидроксидов и солей в воде, то можно заметить, что в некоторых
- 4. Гидролиз солей Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
- 5. Количественной характеристикой Гидролиза солей может служить степень гидролиза (a), определяемая отношением концентрации гидролизованной части молекул к
- 6. Частичный Гидролиз трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент).
- 7. Различают несколько вариантов гидролиза солей: 1. Гидролиз соли слабой кислоты и сильного основания: Na2CO3 + Н2О
- 8. Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно
- 9. При гидролизе жиров в присутствии щелочей получают мыла. Гидролиз жиров в присутствии катализаторов применяется для получения
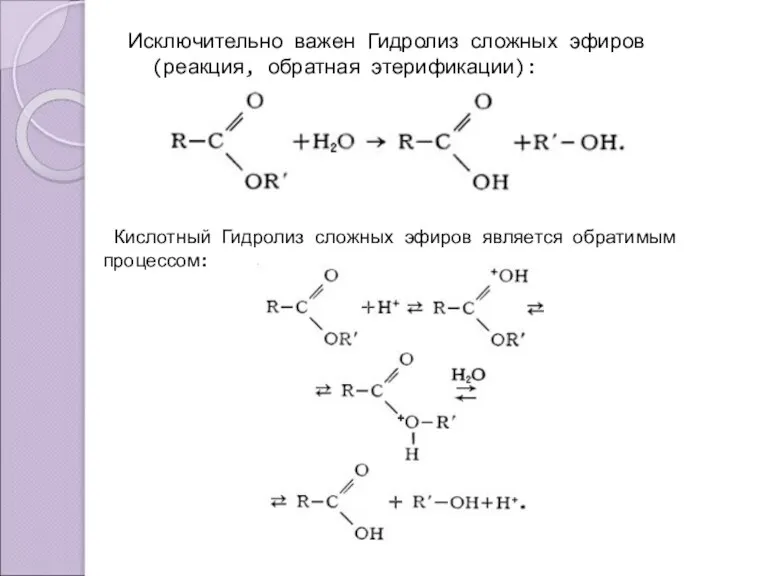
- 10. Исключительно важен Гидролиз сложных эфиров (реакция, обратная этерификации): Кислотный Гидролиз сложных эфиров является обратимым процессом:
- 11. Термин «Гидролиз» обычно применяется в органической химии также по отношению к некоторым процессам, которые более правильно
- 13. Скачать презентацию








 Язык и этнос. Лингвистическая классификация народов мира. Лекция 9
Язык и этнос. Лингвистическая классификация народов мира. Лекция 9 Банкетное меню
Банкетное меню Социальная медицина
Социальная медицина Обобщающий урок по теме:
Обобщающий урок по теме: Станция Ученые
Станция Ученые Презентация на тему Деньги (4 класс)
Презентация на тему Деньги (4 класс) Макроэкономика 2
Макроэкономика 2 Основы организации деятельности: теория управления и практические рекомендации
Основы организации деятельности: теория управления и практические рекомендации Неделя территория без сквернословия
Неделя территория без сквернословия Условия трудовой деятельности
Условия трудовой деятельности  Презентация на тему: Ознакомление дошкольников с правилами пожарной безопасности
Презентация на тему: Ознакомление дошкольников с правилами пожарной безопасности Венера
Венера Особенности развития, абилитации, воспитания, обучения и социально-трудовой адаптации детей с нарушениями речи
Особенности развития, абилитации, воспитания, обучения и социально-трудовой адаптации детей с нарушениями речи Электронные библиотеки и библиотеки: на пути к совершенным интеллектуальным поисковым системам Шрайберг Яков Леонидович, докто
Электронные библиотеки и библиотеки: на пути к совершенным интеллектуальным поисковым системам Шрайберг Яков Леонидович, докто Фитоиндикация типов леса по А. С. Барабанщикову по Д. А. Цыганову в сравнении с Погребняком
Фитоиндикация типов леса по А. С. Барабанщикову по Д. А. Цыганову в сравнении с Погребняком Блюда из яиц
Блюда из яиц Презентация на тему Влияние токсических веществ на организм человека
Презентация на тему Влияние токсических веществ на организм человека  Урок русского языка в 5 классеУчитель Сухицкая В.Т.Брянский городской лицей №1имени А.С.Пушкина
Урок русского языка в 5 классеУчитель Сухицкая В.Т.Брянский городской лицей №1имени А.С.Пушкина Щенок из гофрокартона
Щенок из гофрокартона Что делать сегодня, чтобы уже завтра говорить на французском
Что делать сегодня, чтобы уже завтра говорить на французском Перпендикуляр и наклонная. Выполнить чертёж
Перпендикуляр и наклонная. Выполнить чертёж Презентация на тему Защита файлов и управление доступом к ним.
Презентация на тему Защита файлов и управление доступом к ним. Практика
Практика Мировые информационные ресурсы. Классификация. (Лекция 2)
Мировые информационные ресурсы. Классификация. (Лекция 2) Масленица
Масленица Крыжановская М.Р._ Типы предприятий города Каменска-Уральского
Крыжановская М.Р._ Типы предприятий города Каменска-Уральского Региональный комплексный проект модернизации образования в МОУ "СОШ" с. Эльбрус
Региональный комплексный проект модернизации образования в МОУ "СОШ" с. Эльбрус ДИСКРЕТНЫЕ АВТОМАТИЧЕСКИЕ СИСТЕМЫ
ДИСКРЕТНЫЕ АВТОМАТИЧЕСКИЕ СИСТЕМЫ