Содержание
- 2. Свойства летучих горючих металлов и их оксидов На способность металлов возгораться и гореть большое влияние оказывают
- 3. Свойства нелетучих горючих металлов и их оксидов
- 4. Рассмотрим кинетические законы окисления и механизм самовоспламенения одиноких частиц металла. В пред нагревательном периоде (от Т0
- 5. Кинетические законы
- 8. Классификация металлов по механизму горения: летучие (кальций, магний) – горящие в паро-фазном режиме; нелетучие: с растворимой
- 9. При исследованиях было выявлено несколько механизмов потери защитных свойств оксидной пленки: общий механизм: у оксидной пленки
- 10. Схема разрушения оксидной пленки.
- 12. Скачать презентацию
Слайд 2Свойства летучих горючих металлов и их оксидов
На способность металлов возгораться и гореть
Свойства летучих горючих металлов и их оксидов
На способность металлов возгораться и гореть
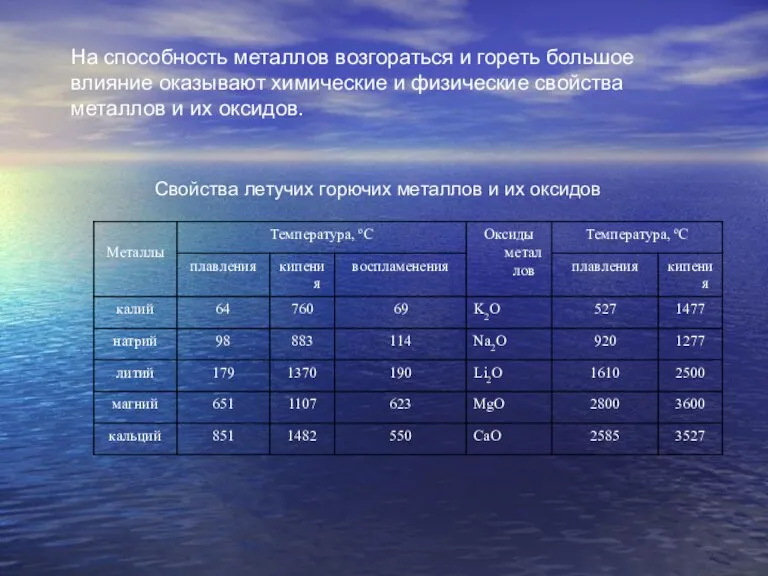
большое
влияние оказывают химические и физические свойства металлов и их оксидов.
влияние оказывают химические и физические свойства металлов и их оксидов.
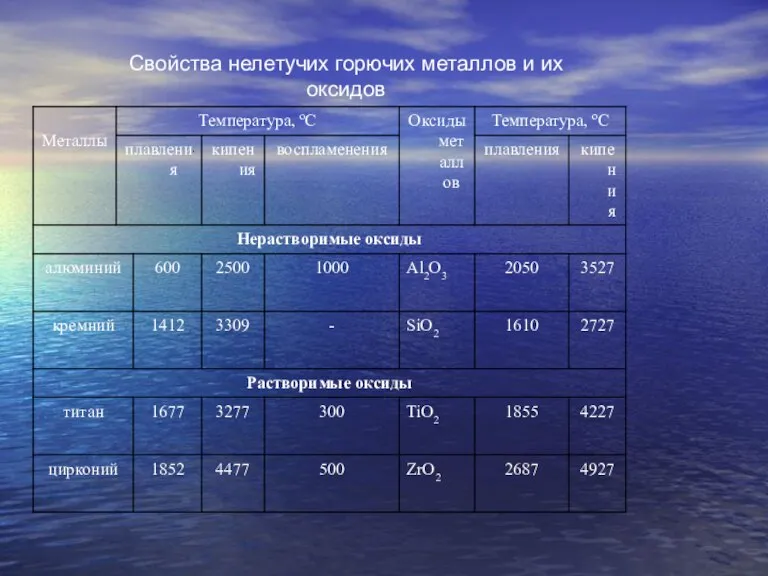
Слайд 3Свойства нелетучих горючих металлов и их оксидов
Свойства нелетучих горючих металлов и их оксидов
Слайд 4Рассмотрим кинетические законы окисления и механизм самовоспламенения одиноких частиц металла. В пред
Рассмотрим кинетические законы окисления и механизм самовоспламенения одиноких частиц металла. В пред

нагревательном периоде (от Т0 до Т1) ведущая роль отводится процессу окисления металла. При окислении частиц образуется твердый оксид металла и поглощается большое количество тепла, которое препятствует горению. Большое влияние оказывает также толщина оксидной пленки и ее дисперсность. Пирофорные металлы – это металлы без оксидной пленки.
Стадия образования оксидной пленки – диффузионное препятствие для процессов горения и взрывов, при этом увеличивается плотность кристаллической решетки оксидной пленки.
Стадия образования оксидной пленки – диффузионное препятствие для процессов горения и взрывов, при этом увеличивается плотность кристаллической решетки оксидной пленки.
Зависимость скорости окисления от времени;
1 – линейная; 2 – параболическая;
3 – кубическая; 4 – логарифмическая
Слайд 5Кинетические законы
Кинетические законы

Слайд 8Классификация металлов по механизму горения: летучие (кальций, магний) – горящие в паро-фазном
Классификация металлов по механизму горения: летучие (кальций, магний) – горящие в паро-фазном

режиме; нелетучие: с растворимой оксидной пленкой (в самом расплавленном металле – цирконий); с нерастворимой, но легкокипящей пленкой (бор) воспламенение протекает уже сложнее; с нерастворимой и трудно- кипящей пленкой (алюминий, кремний) воспламенение этих металлов наиболее сложное.
Процессы горения металла не зависят от первоначальной формы металла, металлы горят в шарообразной форме, поэтому ошибки в вычислениях почти нет. Если объем оксидной пленки больше объема металла, то оксидная пленка покрывает весь металл и является защитной; если объем оксидной пленки меньше объема металла, то оксидная пленка не является защитной.
k ПБ– коэффициент Пиминга-Бевордса, если этот коэффициент ≥1, то оксидная пленка защитная. Например,Mg kПБ =0,8, Ca kПБ =0,6 .
Процессы горения металла не зависят от первоначальной формы металла, металлы горят в шарообразной форме, поэтому ошибки в вычислениях почти нет. Если объем оксидной пленки больше объема металла, то оксидная пленка покрывает весь металл и является защитной; если объем оксидной пленки меньше объема металла, то оксидная пленка не является защитной.
k ПБ– коэффициент Пиминга-Бевордса, если этот коэффициент ≥1, то оксидная пленка защитная. Например,Mg kПБ =0,8, Ca kПБ =0,6 .
Слайд 9При исследованиях было выявлено несколько механизмов потери защитных свойств оксидной пленки:
общий механизм:
При исследованиях было выявлено несколько механизмов потери защитных свойств оксидной пленки:
общий механизм:

у оксидной пленки и металлического ядра различные коэффициенты термического расширения (у оксидной пленки этот коэффициент меньше), при увеличении температуры возникают напряжения, которые ведут к растрескиванию оксидной пленки;
растворение пленки в металле; при нагревании частички титана и циркония в вакууме или в атмосфере аргона, извлекают в среду и поджигают, при этом увеличивается воспламеняемость( кислород из поверхности частично диффундирует внутрь ядра);
фазовые и агрегатные переходы в оксидной пленке и в металле; испарение (Mg), плавление (Al) металла – пленка лопается объем жидкости больше чем объем твердого вещества – пленка разрушается; при плавлении оксида увеличивается способность кислорода диффундировать через пленку внутрь металла; например, испарение оксида молибдена при переходе из α в β модификации (модификационный переход) изменяется объем оксидной пленки;
химические превращения; в состав оксидной пленки входят гидроксиды, карбонаты; при достижении температуры распада, защитные свойства пленки теряются (рис. 36). Схема разрушения оксидной пленки.
Инертные примеси; некоторые резко увеличивают скорость окисления и снижают температуру самовоспламенения; те добавки, которые дают с оксидом сплавы с низкой температурой плавления (сплав алюминия с фторидами).
растворение пленки в металле; при нагревании частички титана и циркония в вакууме или в атмосфере аргона, извлекают в среду и поджигают, при этом увеличивается воспламеняемость( кислород из поверхности частично диффундирует внутрь ядра);
фазовые и агрегатные переходы в оксидной пленке и в металле; испарение (Mg), плавление (Al) металла – пленка лопается объем жидкости больше чем объем твердого вещества – пленка разрушается; при плавлении оксида увеличивается способность кислорода диффундировать через пленку внутрь металла; например, испарение оксида молибдена при переходе из α в β модификации (модификационный переход) изменяется объем оксидной пленки;
химические превращения; в состав оксидной пленки входят гидроксиды, карбонаты; при достижении температуры распада, защитные свойства пленки теряются (рис. 36). Схема разрушения оксидной пленки.
Инертные примеси; некоторые резко увеличивают скорость окисления и снижают температуру самовоспламенения; те добавки, которые дают с оксидом сплавы с низкой температурой плавления (сплав алюминия с фторидами).
Слайд 10Схема разрушения оксидной пленки.
Схема разрушения оксидной пленки.

Следующая -
Вода. Знакомая незнакомка

 Влияние алкоголя и табака на организм человека
Влияние алкоголя и табака на организм человека Использование новых информационных технологий в учебном процессе в начальных классах с раздельным обучением.
Использование новых информационных технологий в учебном процессе в начальных классах с раздельным обучением. Зимний П. Вахтан
Зимний П. Вахтан Презентация на тему Экскурсионная работа в преподавании Мировой Художественной культуры
Презентация на тему Экскурсионная работа в преподавании Мировой Художественной культуры Департамент инвестиционной политики и государственной поддержки предпринимательства Тюменской области
Департамент инвестиционной политики и государственной поддержки предпринимательства Тюменской области Субъекты и участники обязательного медицинского страхования: понятие и различие правового статуса
Субъекты и участники обязательного медицинского страхования: понятие и различие правового статуса Арзылан-ыт
Арзылан-ыт Отраслевое административно-правовое регулирование в хозяйственно-экономических комплексах
Отраслевое административно-правовое регулирование в хозяйственно-экономических комплексах Особенности теории как формы научного познания
Особенности теории как формы научного познания amazing-facts-about-china
amazing-facts-about-china Презентация на тему Квадратный корень.Арифметический квадратный корень
Презентация на тему Квадратный корень.Арифметический квадратный корень Фитонцидные растения
Фитонцидные растения Региональный центр подготовки и творческого развития школьников Технариум, г. Саратов
Региональный центр подготовки и творческого развития школьников Технариум, г. Саратов Fashion Pepper. Фото-моделінг і Моделінг
Fashion Pepper. Фото-моделінг і Моделінг Brand Mapping. Магазин свечей ТЕПЛО
Brand Mapping. Магазин свечей ТЕПЛО Аварии на радиационно опасных объектах
Аварии на радиационно опасных объектах Презентация на тему М.Ю. Лермонтов «Дары Терека»
Презентация на тему М.Ю. Лермонтов «Дары Терека» Magniy_Kinakh_12_gr-WPS_Office
Magniy_Kinakh_12_gr-WPS_Office До свиданья, начальная школа!
До свиданья, начальная школа! Этапы КП
Этапы КП Страна чудес
Страна чудес Как близки к нам биоматериалы «Аллоплант»
Как близки к нам биоматериалы «Аллоплант» Презентация на тему Дымник
Презентация на тему Дымник 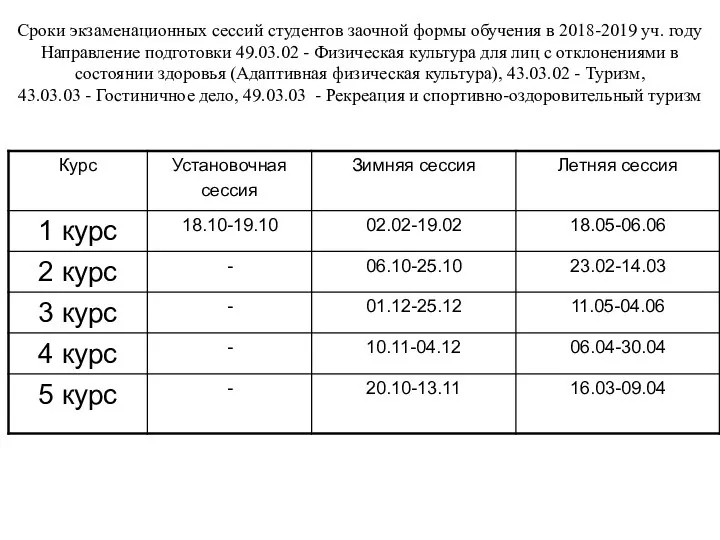 Сроки экзаменационных сессий студентов заочной формы обучения в 2018-2019 уч. году
Сроки экзаменационных сессий студентов заочной формы обучения в 2018-2019 уч. году Города-государства «железного века». VIII-VI вв. до н.э.
Города-государства «железного века». VIII-VI вв. до н.э. Звуки и буквы
Звуки и буквы Ферменты. Витамины. Гормоны
Ферменты. Витамины. Гормоны Презентация на тему Внешняя политика Гитлера
Презентация на тему Внешняя политика Гитлера