Содержание
- 2. Ток обмена При i0→0 - идеально поляризуемый электрод При i0→∞ - идеально неполяризуемый электрод
- 3. Поляризационное сопротивление Допустим, что электрохимическая система незначительно отклоняется от состояния равновесия (перенапряжение η→0). Сопротивление переноса заряда
- 4. Уравнение Тафеля Юлиус Тафель 1862 – 1918 гг. Предложил уравнение для связи скорости электрохимической реакции и
- 5. Уравнение Тафеля Предположим, что система существенно отклоняется от Ep и Тогда Ox + e = Red
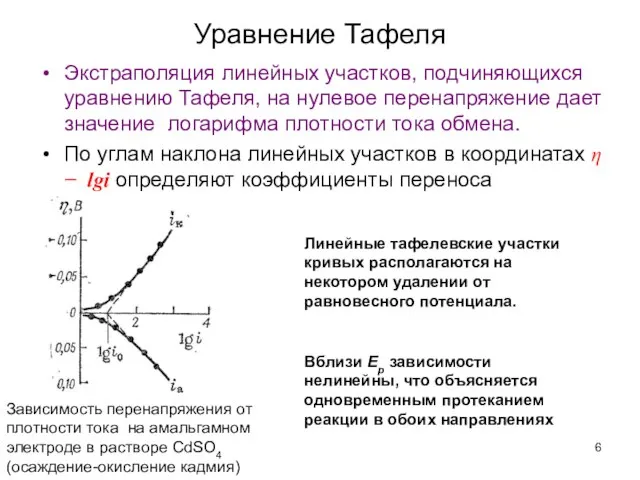
- 6. Экстраполяция линейных участков, подчиняющихся уравнению Тафеля, на нулевое перенапряжение дает значение логарифма плотности тока обмена. По
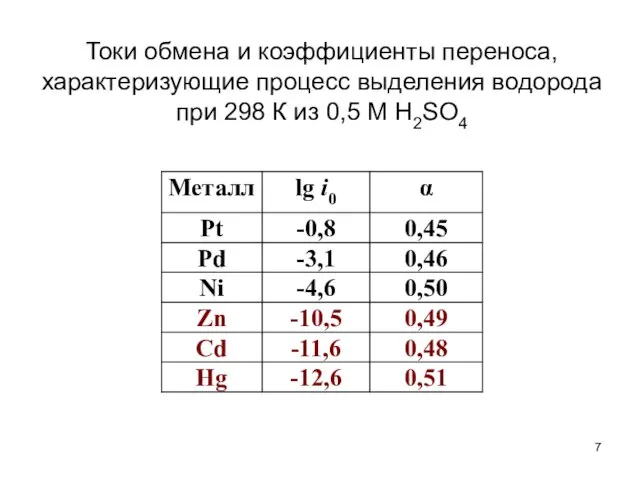
- 7. Токи обмена и коэффициенты переноса, характеризующие процесс выделения водорода при 298 К из 0,5 М H2SO4
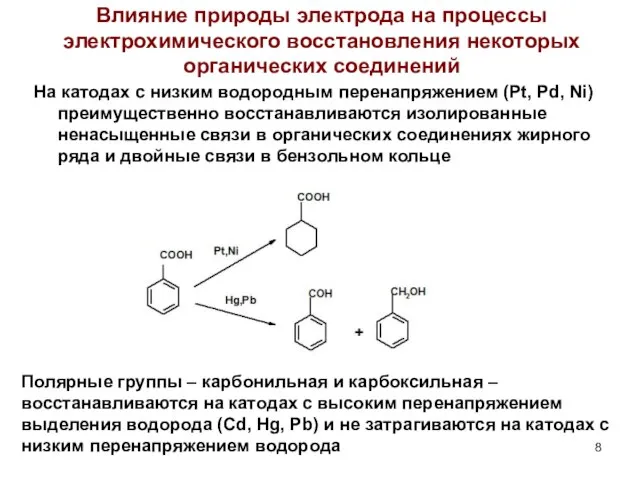
- 8. Влияние природы электрода на процессы электрохимического восстановления некоторых органических соединений На катодах с низким водородным перенапряжением
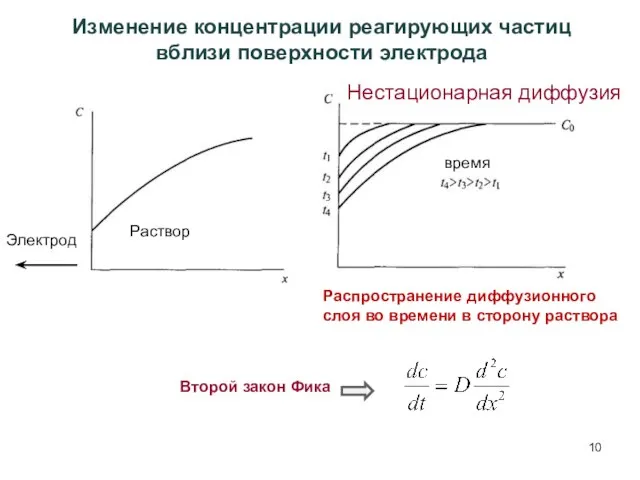
- 9. Перенапряжение диффузии Диффузионным перенапряжением ηD называют перенапряжение, связанное с заторможенностью стадии диффузионного подвода реагентов из раствора
- 10. Распространение диффузионного слоя во времени в сторону раствора Изменение концентрации реагирующих частиц вблизи поверхности электрода Электрод
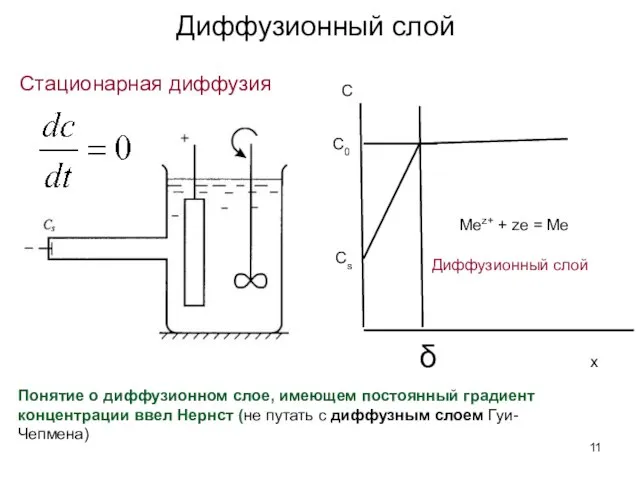
- 11. Стационарная диффузия С С0 Сs δ x Понятие о диффузионном слое, имеющем постоянный градиент концентрации ввел
- 12. Диффузионный слой При естественной конвекции в водных растворах δ=0.03-0.05 см и зависит от плотности и вязкости
- 13. Предельный диффузионный ток Для стационарной диффузии:
- 14. Равновесный потенциал Потенциал под током Перенапряжение Диффузионное перенапряжение
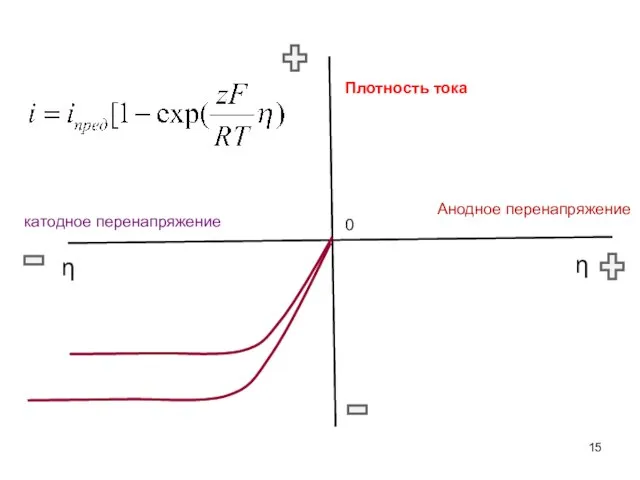
- 15. Анодное перенапряжение катодное перенапряжение 0 η Плотность тока η
- 16. Вывод уравнения полярографической волны
- 17. Уравнение полярографической волны: E1/2
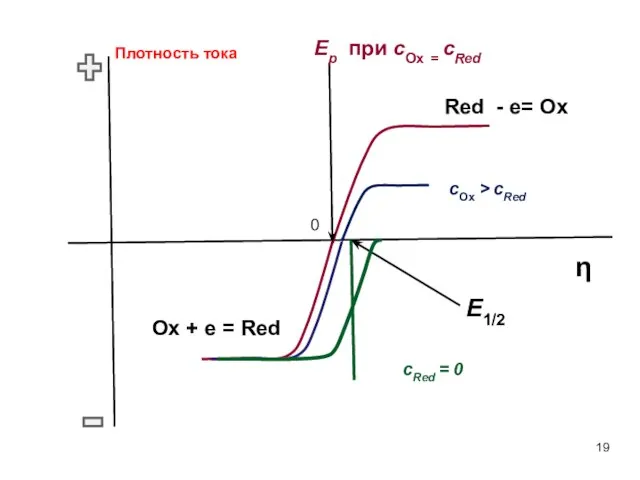
- 18. 1) Значения E1/2 близки к E0 , т.к. DOx ≈ DRed 2) При сred = 0
- 19. 0 Плотность тока η Ep при сOx = сRed Red - e= Ox Ox + e
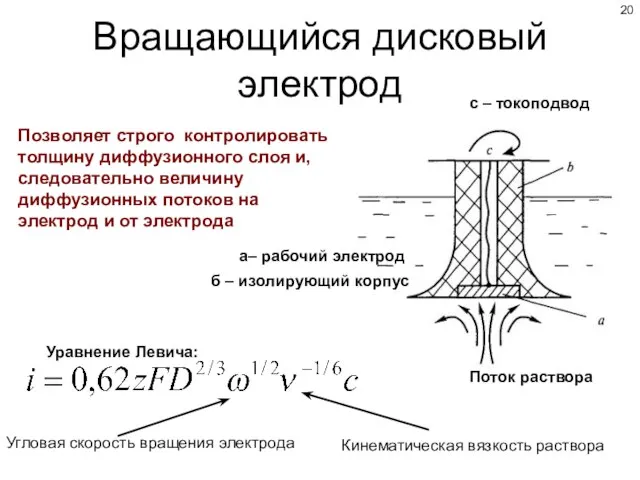
- 20. Вращающийся дисковый электрод Позволяет строго контролировать толщину диффузионного слоя и, следовательно величину диффузионных потоков на электрод
- 21. Три уравнения диффузионной электрохимической кинетики
- 22. Совместное и индивидуальное электрохимическое осаждение металлов Имеется раствор, содержащий Pb(NO3)2 и AgNO3 1) Как электрохимически выделить
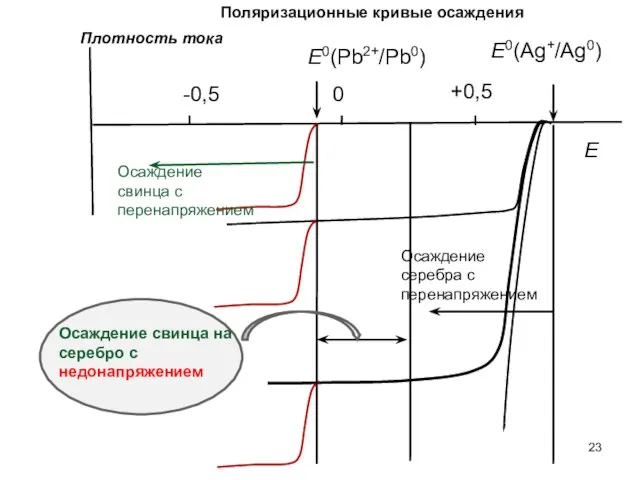
- 23. 0 -0,5 +0,5 E0(Pb2+/Pb0) E0(Ag+/Ag0) Плотность тока Осаждение свинца с перенапряжением Осаждение серебра с перенапряжением Осаждение
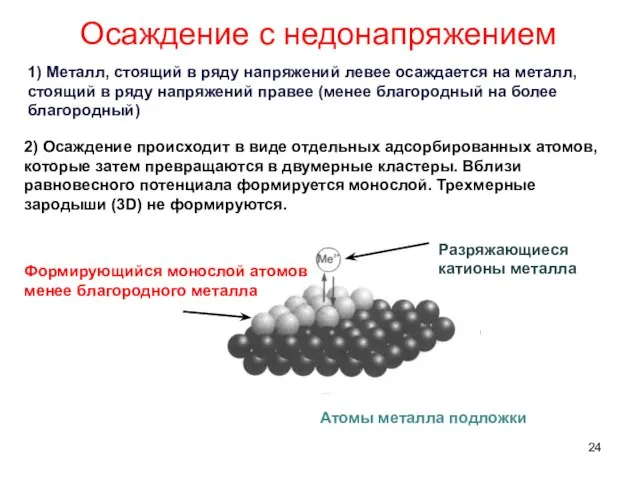
- 24. Осаждение с недонапряжением 1) Металл, стоящий в ряду напряжений левее осаждается на металл, стоящий в ряду
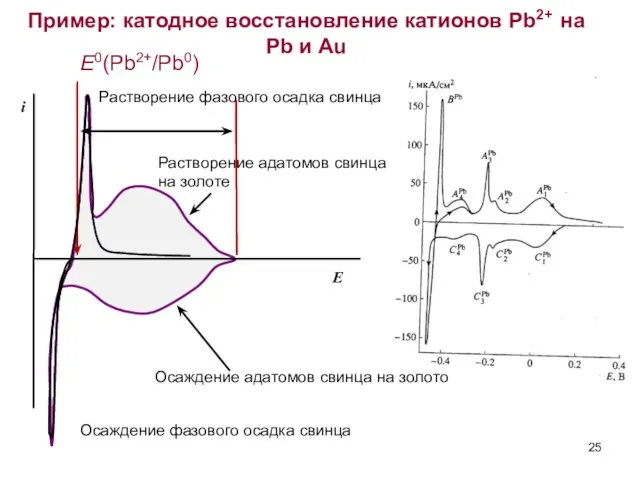
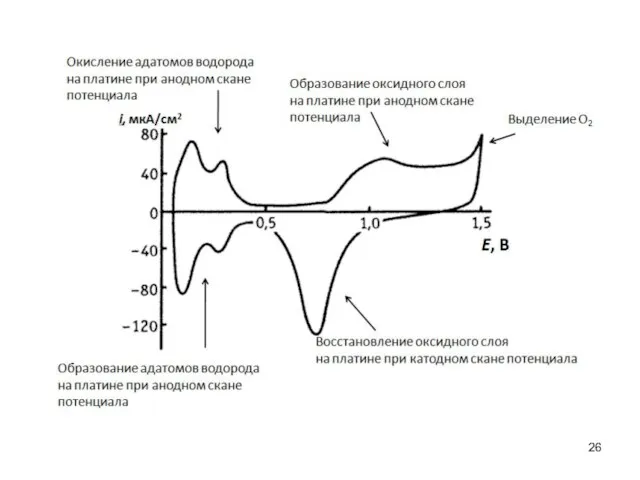
- 25. Пример: катодное восстановление катионов Pb2+ на Pb и Au E0(Pb2+/Pb0) Осаждение адатомов свинца на золото Растворение
- 27. Перенапряжение диффузии с учетом миграции Допустим, что электролизу подвергают электролит, содержащий лишь один тип катионов и
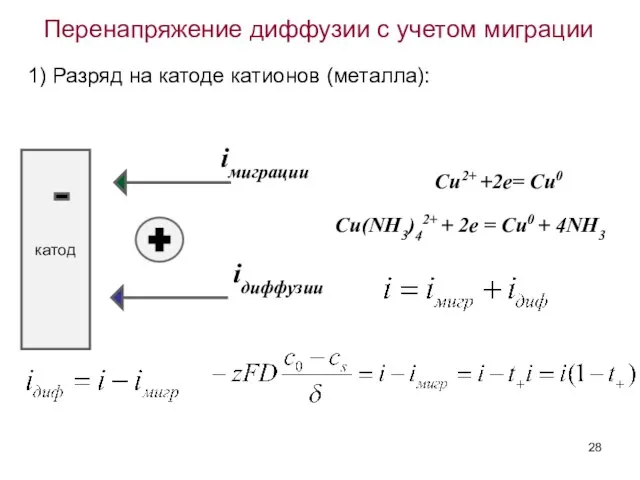
- 28. Перенапряжение диффузии с учетом миграции 1) Разряд на катоде катионов (металла): катод iдиффузии iмиграции Cu2+ +2e=
- 29. 1) Разряд на катоде катионов металла 0,1 M CuSO4 0,1 M CuSO4 + 1 M Na2SO4
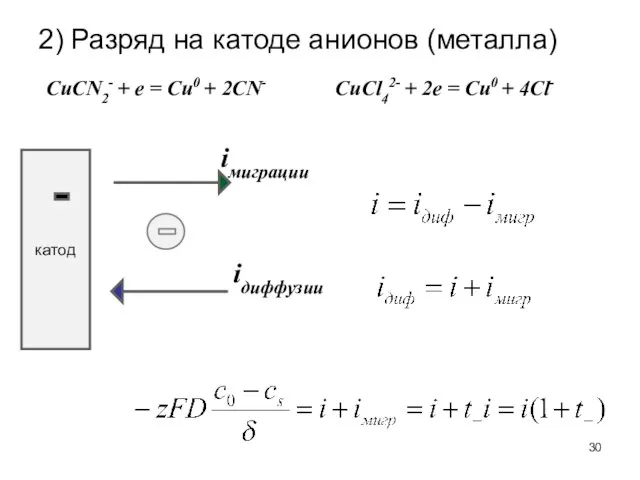
- 30. 2) Разряд на катоде анионов (металла) катод iдиффузии iмиграции CuСl42- + 2e = Cu0 + 4Cl-
- 31. 2) Разряд на катоде анионов (металла) 0,05 M Na[Cu(CN)2] 0,05 M Na[Cu(CN)2] + 1 M Na2SO4
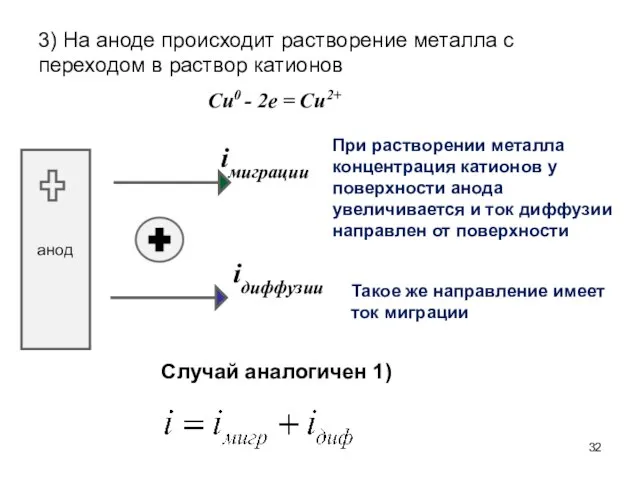
- 32. 3) На аноде происходит растворение металла с переходом в раствор катионов Cu0 - 2e = Cu2+
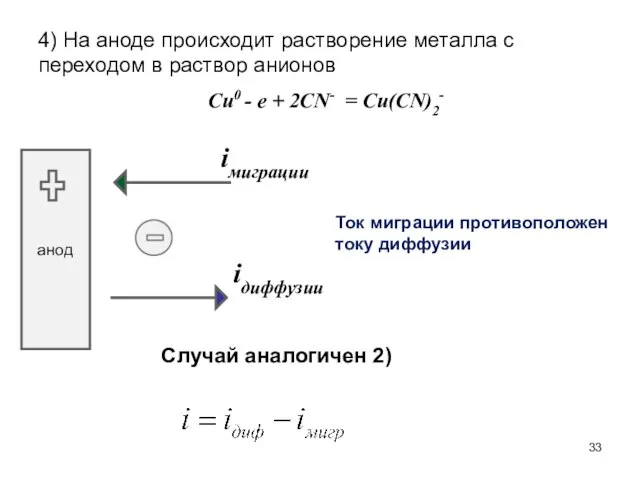
- 33. 4) На аноде происходит растворение металла с переходом в раствор анионов Cu0 - e + 2CN-
- 34. Короткозамкнутые электрохимические системы Обычные электрохимические системы, например типа —Zn|ZnSO4||СuSO4|Cu могут находиться либо в разомкнутом, либо в
- 35. Короткозамкнутые электрохимические системы Железная пластинка в растворе серной кислоты Цинковая пластинка в растворе сульфата меди
- 36. Короткозамкнутые электрохимические системы в которых анодным процессом является окисление металла и новая металлическая фаза не образуется,
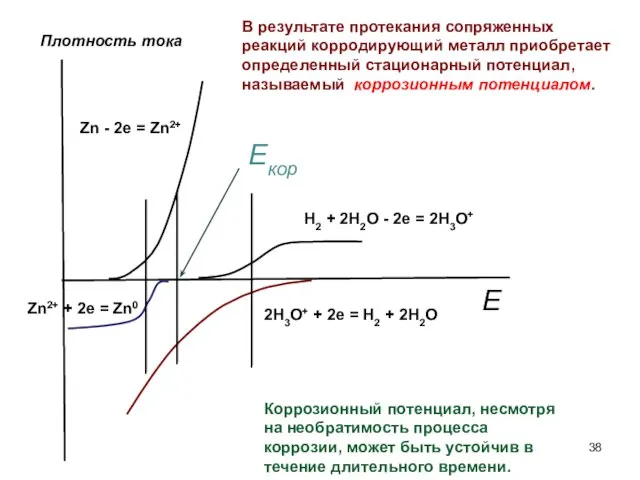
- 37. Электрохимическая коррозия В коррозионной электрохимической системе идет процесс самопроизвольного разрушения металла (коррозия) при воздействии на него
- 38. Zn - 2e = Zn2+ Zn2+ + 2e = Zn0 Плотность тока В результате протекания сопряженных
- 40. Скачать презентацию















![2) Разряд на катоде анионов (металла) 0,05 M Na[Cu(CN)2] 0,05 M Na[Cu(CN)2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374268/slide-30.jpg)




 Система листопроводки печатной машины
Система листопроводки печатной машины Значение международного языка в нашей жизни
Значение международного языка в нашей жизни Уличные газовые инфракрасные обогреватели
Уличные газовые инфракрасные обогреватели Лекция 1. Вводная
Лекция 1. Вводная Презентация на тему Брестская крепость
Презентация на тему Брестская крепость  Программа II.7.4 «Наноструктурные слои и покрытия: оборудование, процессы, применения»
Программа II.7.4 «Наноструктурные слои и покрытия: оборудование, процессы, применения» Нобелевский лауреат Мария Склодовская-Кюри
Нобелевский лауреат Мария Склодовская-Кюри Иванова Надежда Сергеевна – заведующая кафедрой естественно-математических дисциплин
Иванова Надежда Сергеевна – заведующая кафедрой естественно-математических дисциплин Эта мантра из Индии.
Эта мантра из Индии. Муниципальная модель реструктуризации социальной сферы Канск
Муниципальная модель реструктуризации социальной сферы Канск Проект 11 класс
Проект 11 класс "ПО ДОРОГАМ ГРАЖДАНСКОЙ ВОЙНЫ"
"ПО ДОРОГАМ ГРАЖДАНСКОЙ ВОЙНЫ" You can read
You can read Тимченко В.И., учитель истории и обществоведения
Тимченко В.И., учитель истории и обществоведения Кровотечения. Первая помощь при кровотечениях
Кровотечения. Первая помощь при кровотечениях Андреев Александр Александрович д.пед.н, к.т.н, профессор, завкафедрой педагогики Московской финансово-промышленной академии.
Андреев Александр Александрович д.пед.н, к.т.н, профессор, завкафедрой педагогики Московской финансово-промышленной академии.  Альтернативная гражданская служба
Альтернативная гражданская служба Политическая мода и высокая мода
Политическая мода и высокая мода Основные понятия термины
Основные понятия термины Тонкие вычисления. Устройства и ПО: Мощь ПК при невысокой сложности
Тонкие вычисления. Устройства и ПО: Мощь ПК при невысокой сложности Мосты сотрудничества. Пригласительный
Мосты сотрудничества. Пригласительный Презентация на тему Лобачевский презентация
Презентация на тему Лобачевский презентация «1С:Спиртовое производство»
«1С:Спиртовое производство» Экскурсия по Красной площади
Экскурсия по Красной площади Цена вопроса…Цена ответа…
Цена вопроса…Цена ответа… Отступы и списки
Отступы и списки Моя наука
Моя наука Урок _ 5_6
Урок _ 5_6