Слайд 2 Изомерия КС
Изомерией называется такое явление, когда вещества, имеющие одинаковый состав, обладают

различным строением и, следовательно, различными свойствами. В химии комплексных соединений это явление весьма распространено. Различают геометрическую, оптическую, гидратную, ионизационную и другие виды изомерии.
Геометрическая изомерия
Геометрическая изомерия комплексных соединений наблюдается в тех случаях, когда лиганды во внутренней сфере располагаются по-разному относительно друг друга, число изомеров, т. е. число вариантов расположения лигандов, зависит как от строения комплексного соединения, так и от количества неодинаковых лигандов.
Слайд 3 Октаэдрические комплексы
Если все 6 лигандов одинаковы, то отсутствует возможность различного расположения

лигандов по отношению друг к другу, т. е. геометрические изомеры в таком случае существовать не могут. Этот вывод полностью согласуется с опытными данными. До сих пор, действительно, не известен ни один случай геометрической изомерии комплексных соединений типа МеА6 (Me — комплексообразователь, А — лиганд).
Заменой одного лиганда А на другой лиганд В получаем комплексные соединения типа МеА5В. Совершенно ясно, что независимо от того, в какой вершине октаэдра осуществлена замена, положение лиганда В по отношению к остальным пяти лигандам А будет совершенно одинаковое. Поэтому комплексные соединения типа МеА5В, например, нитропруссид-ион [Fe(CN)5NO]2- и другие сходные с ним ионы не имеют геометрических изомеров.
Слайд 4Однако, если в октаэдрическом комплексе два лиганда А заменены на лиганды В,

то возможны два различных расположения лигандов друг относительно друга. Поэтому комплексные соединения типа МеА4В2 имеют 2 геометрических изомера. Если оба лиганда В расположены рядом, то такое соединение называется цис-изомером, если же лиганды В расположены по разные стороны от комплексообразователя, то транс -изомером:
Значительный вклад в изучение таких соединений сделан советскими химиками, и в первую очередь И. И. Черняевым и его сотрудниками. Например в 1950 г. советскими химиками было синтезировано первое соединение типа Ме ABCDEF:
[Pt (NO2) I Br Cl (NH3) (C6H5N)]
Слайд 5Гидратная изомерия
Причиной гидратной изомерии является неодинаковое распределение молекул воды между внутренней и

внешней сферами. Например, в случае хлорида трехвалентного хрома известны следующие три гидратных изомера:
[Cr (OH2 )6]Cl3 [CrCl (OH2 )5]Cl2 H2 O [Cr Cl2(OH2 )4]Cl 2H 2
фиолетовый светло-зеленый темно-зеленый
В том, что изомеры имеют именно такие формулы, можно убедиться, действуя нитратом серебра на их холодные свежеприготовленные и подкисленные азотной кислотой растворы. В случае фиолетового изомера осаждается весь хлор, в случае светло-зеленого — 2/3 и в случае темно-зеленого — 1/3 содержащегося в соединении хлора.
Слайд 6 Ионизационная изомерия
Причиной этого вида изомерии является неодинаковое распределение кислотных остатков между

внутренней и внешней сферами. Ионизационные изомеры известны, например, для соединения CoBrSO4 -5NH3:
[CoBr(NH3)5]SO4 [CoSO4(NH3)5]Br
красно-фиолетовый красный
Нитратом серебра из раствора красно-фиолетового изомера осадить бром не удается. Хлоридом же бария полностью осаждаются все содержащиеся в этом соединении ионы сульфата. В случае красного изомера наблюдается противоположное явление: нитратом серебра осаждается весь содержащийся в соединении бром, а хлоридом бария осадить ионы сульфата не удается.
Слайд 7 Солевая изомерия
Такая изомерия наблюдается в случаях, когда лиганд осуществляет связь с

комплексообразователем посредством нескольких входящих в его состав атомов. В качестве примера можно указать на:
желтый [CoNO2 (NH3)5]Cl2 и красный [CoONO (NH3)5]Cl2.
В первом случае имеется химическая связь N — Со, во втором О—Со.
Слайд 8 Координационная изомерия
Сущность ее ясна из следующих примеров:
[Co(NH3)6] [Cr(CN)6] и [Cr(NH3)6] [Co(CN)6
![Координационная изомерия Сущность ее ясна из следующих примеров: [Co(NH3)6] [Cr(CN)6] и [Cr(NH3)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336095/slide-7.jpg)
]
[Co(NH3)6] [Cr(C204)3] и [Cr(NH3)6] [Co (C2O4)3]
[PtCl(NH3)3] [PdCl3NH3] и [PdCl (NH3)3] [PtCl3NH3]
Слайд 9Способность атомов различных элементов к комплексообразованию. Устойчивость КС.
Прочность образуемых комплексных соединений определяется

прежде всего природой иона-комплексообразователя и лиганда. Наиболее важными характеристиками центрального атома с этой точки зрения являются степень окисления, размеры, электронная структура, поляризующее действие, электроотрицательность. Стабильность хелатов зависит от тех же характеристик лиганда и, кроме того, от природы атома лиганда (донорного атома), через который осуществляется связь с центральным атомом, и степени его поляризуемости, увеличивающейся при наличии двойных связей в молекуле. Координационное число центрального атома, стереохимия и прочность образуемых комплексов определяются этими же характеристиками.
Слайд 10 Исследование зависимости устойчивости комплексов от величины заряда центральных атомов, имеющих практически одинаковый

ионный радиус, позволило установить, что, чем выше положительный заряд, тем, больше прочность комплекса для одного и того же лиганда. Изменение прочности комплекса с изменением заряда в случае центральных атомов с законченной восьмиэлектронной оболочкой, по данным Яцимирского, происходит настолько закономерно, что возможно нахождение неизвестных значений констант устойчивости некоторых комплексов путем эстраполяции. Однако иногда такая закономерность нарушается, что связано, в частности, с образованием π-связей между лигандом и центральным атомом.
На основании экспериментальных данных и теоретических предпосылок было показано, что устойчивость комплекса с изменением радиуса центрального атома может увеличиваться, уменьшаться или проходить через максимум.
Слайд 11 Практически существуют некоторые оптимальные соотношения размеров взаимодействующих агентов, которые обеспечивают максимальную устойчивость

комплекса при прочих равных условиях. Так, в ряду этилендиаминтетрацетатов щелочноземельных металлов максимальной устойчивостью обладает комплекс кальция, в ряду переходных металлов — меди или железа, в ряду редкоземельных элементов — лютеция.
Корреляция между устойчивостью комплексов и размером иона металла для большого числа лигандов позволила выявить «естественные ряды» изменения прочности КС для некоторых групп родственных катионов с одинаковым зарядом.
Слайд 12
Зависимость констант устойчивости комплексов ЭДТА (1) и 2-оксиэтилэтилендиаминтриуксусной кислоты (2) от атомного
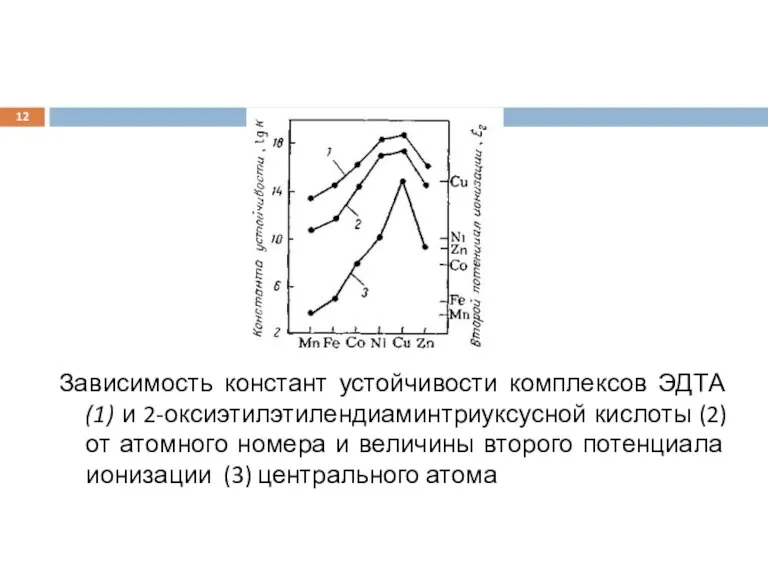
номера и величины второго потенциала ионизации (3) центрального атома
Слайд 13Это особенно характерно для щелочных (Li+>Na+ >K+>Rb+>Cs+) и
щелочноземельных (Mg2+ > Са2+ >

Sr2+ > Ва2+) и некоторых d-элементов
первого переходного периода Мn2+< Fe2+ < Co2+< Ni2+ < Cu 2+ < Zn 2+
так называемый ряд Ирвинга — Вильямса — Яцимирского.
Изменение устойчивости комплексов в каждом из рядов может быть объяснено на основании электростатической модели с учетом изменения энтропии в водных растворах. Так, закономерность Ирвинга — Вильямса — Яцимирского для ряда элементов с d-электронами первого переходного периода интерпретирована на основании корреляции прочности комплексов со значениями вторых потенциалов ионизации центральных ионов и их ионными радиусами (рис.), а также на основании теории кристаллического поля.
Слайд 14 В зависимости от типа рассматриваемого металла изменяется способность его преимущественно координироваться с

атомами азота, кислорода или серы, которые служат непосредственно донорными атомами в подавляющем большинстве комплексных соединений.
Направленность связей иона металла в пространстве обусловливается его электронной структурой и типом гибридизации. В результате перераспределения электронов по энергетическим уровням могут возникнуть, например, четыре эквивалентные гибридные орбитали, направленные к углам тетраэдра или квадрата, или шесть орбиталей, направленные к углам октаэдра. В первом случае к. ч. 4, во втором — 6.
Для примера рассмотрим комплексное соединение с координационным числом шесть. Согласно методу молекулярных орбиталей, шесть эквивалентных связывающих орбиталей могут быть образованы у элементов первого большого периода при d2sp3 гибридизации. Так, для иона кобальта (III) характерна следующая конфигурация: 3d6 4s0
При взаимодействии катиона с лигандом, например с этилендиаминтетрауксусной кислотой (ЭДТА), молекула этого гексадентатного комплексона может предоставить для образования шести связей шесть пар электронов. Ион кобальта предоставляет этим электронам шесть эквивалентных орбиталей в результате следующей перегруппировки: d-электроны, находившиеся каждый на своей орбитали, спариваются, освобождая при этом для гибридизации две d – орбитали.
Слайд 15В результате шесть свободных орбиталей принимают электроны, образуя шесть эквивалентных гибридных связей

d2sp3. Окончательное распределение электронов представлено ниже:
В рассмотренном примере в гибридизации участвуют d-орбитали более низкого главного энергетического уровня (n = 3), чем s-и р-орбитали (n = 4). Такие комплексы — (n — 1) d2nsnp3 — называют низкоспиновыми. Для катионов с к. ч. 4 низкоспиновым комплексам соответствует гибридизация dsp2 и d3s.
Низкоспиновые комплексы являются наиболее устойчивыми, что объясняется проникновением двух (для к. ч. 6) или одной (для к. ч. 4) пар электронов на более глубокий (низкий), а следовательно, и более устойчивый энергетический уровень атома-акцептора.
Слайд 16 Парамагнитная восприимчивость таких комплексов в результате уменьшения числа неспаренных электронов уменьшается. В

некоторых случаях вследствие полного спаривания всех электронов d-уровня комплексы становятся диамагнитными. Если расщепление кристаллическим полем недостаточно, электроны не спариваются, гибридизация при этом происходит за счет s-, p- и d-орбиталей одного главного энергетического уровня, например nsnp3nd2, т. е. sp3d2. Подобные комплексы называются высокоспиновыми (d-электроны не спарены).
Возможные наборы гибридных орбиталей, определяющие геометрическую конфигурацию молекулы при образовании координационных соединений, приведены в табл. 1.
Как правило, комплексы с к. ч. 4 имеют плоское или тетраэдрическое строение, с к. ч. 6 — октаэдрическое. Однако для комплексов переходных металлов часто наблюдаются искажения этих конфигураций, что связано с наличием в комплексах частично заполненных d-орбиталей.
Слайд 17Таблица 1. Гибридизация и пространственные конфигурации для комплексов, центральные атомы которых имеют
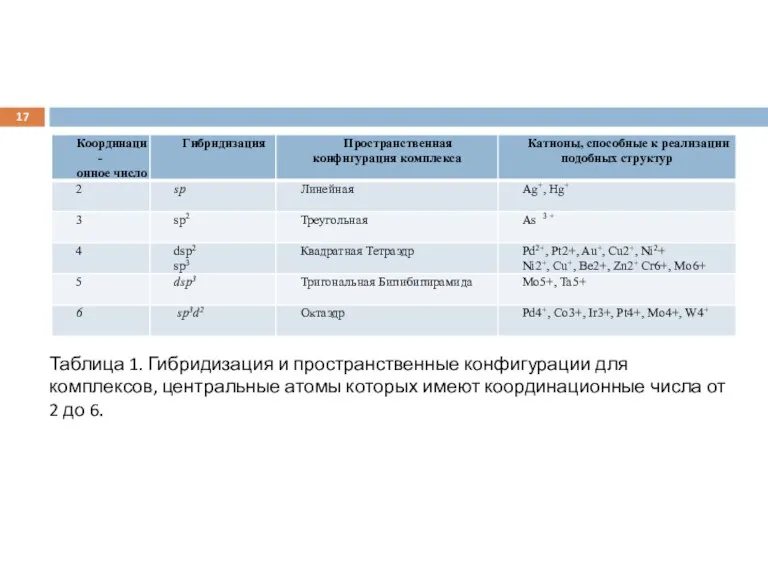
координационные числа от 2 до 6.
Слайд 18 Зависимость прочности комплексов от свойств лиганда можно рассматривать с двух точек зрения

— влияния природы донорного атома и эффектов, связанных с образованием циклов. Природа лиганда в такой же степени, как и центрального атома, определяет устойчивость комплексного соединения. На прочность комплексов влияют следующие факторы.
электростатические характеристики (заряд, радиус) донорных атомов и дипольный момент координируемых групп. Чем выше заряд и меньше радиус донорного атома, тем прочнее соответствующий комплекс. Прочности комплекса способствует также большая поляризуемость лиганда, которая увеличивается в соответствии со следующим рядом донорных атомов
О < N < S < Se. Наличие двойных связей в лиганде также увеличивает его поляризуемость.
тенденция донорных атомов лиганда к образованию сигма-связей. Реализация пи-связей способствует еще большей прочности комплексов.
Слайд 19 На донорные свойства координируемого атома оказывает влияние вся молекула лиганда. Так, атом

азота в гетероциклических аминах передает электронную пару катиону-комплексообразователю труднее, чем в аммиаке. Оттягивание электронов от лиганда к катиону может быть затруднено вследствие индукционного эффекта, создаваемого введенными в молекулу лиганда электрофильными заместителями, и, наконец, большую роль при комплексообразовании имеет стереохимия лиганда в целом.
Несомненную роль играет и возможный процесс циклообразования в случае полидентатных комплексообразующих реагентов, к которым относятся и комплексоны. Отличительной особенностью образуемых при этом хелатных комплексов является их большая термодинамическая устойчивость.






![Координационная изомерия Сущность ее ясна из следующих примеров: [Co(NH3)6] [Cr(CN)6] и [Cr(NH3)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336095/slide-7.jpg)











 Адреномиметики
Адреномиметики Sport in Canada
Sport in Canada АО Вюрт Северо-Запад, Санкт-Петербург. Боулинг–турнир. Месяц новых клиентов
АО Вюрт Северо-Запад, Санкт-Петербург. Боулинг–турнир. Месяц новых клиентов Презентация на тему Русский герой сказок: Иван-дурак
Презентация на тему Русский герой сказок: Иван-дурак  Путешествие на водопад Атыш
Путешествие на водопад Атыш Помада Creamy Glam
Помада Creamy Glam Презентация по английскому Королевская семья Великобритании
Презентация по английскому Королевская семья Великобритании tema-gribi-rodnaya-tropinka_ru
tema-gribi-rodnaya-tropinka_ru Работа социального педагога с детьми имеющих отклоняющее поведение.
Работа социального педагога с детьми имеющих отклоняющее поведение. Комплекс упражнений утренней гимнастики
Комплекс упражнений утренней гимнастики Службы для электронного общения
Службы для электронного общения Характер и темперамент
Характер и темперамент Обществознание
Обществознание Материально-техническая база одно из условий эффективной реализации профильного обучения.
Материально-техническая база одно из условий эффективной реализации профильного обучения. Способ тепловой обработки сыпучих материалов и устройства для его осуществления
Способ тепловой обработки сыпучих материалов и устройства для его осуществления Архитектура Санкт-Петербурга
Архитектура Санкт-Петербурга project
project Greenway. Жизнь без химии с заботой о семье и природе
Greenway. Жизнь без химии с заботой о семье и природе Адрес: Тверская область, г. Нелидово Ул. Шахтерская 16
Адрес: Тверская область, г. Нелидово Ул. Шахтерская 16 Сказочные птицы
Сказочные птицы Леонардо Да Винчи
Леонардо Да Винчи Как преодолеть стресс перед экзаменом
Как преодолеть стресс перед экзаменом Признаки нарушения адаптации в почерке
Признаки нарушения адаптации в почерке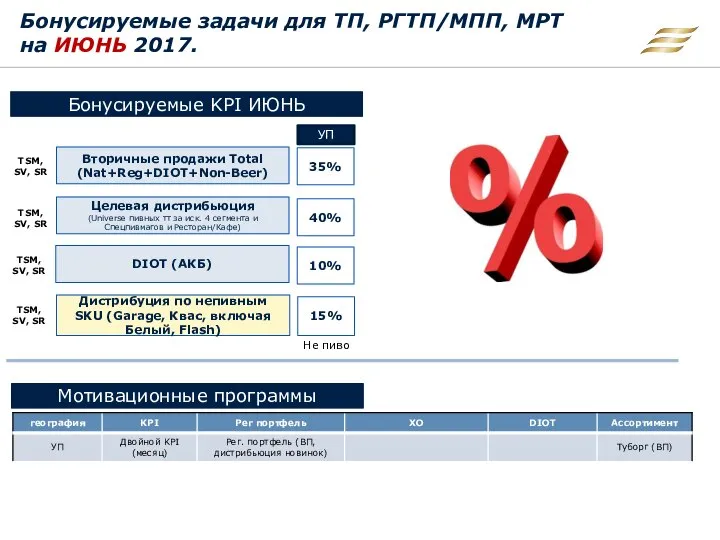 Бонусируемые задачи для ТП, РГТП/МПП, МРТ на июнь 2017
Бонусируемые задачи для ТП, РГТП/МПП, МРТ на июнь 2017 Доходы предприятия и финансовые результаты его деятельности
Доходы предприятия и финансовые результаты его деятельности Алтайский государственный университет
Алтайский государственный университет Методика оформление. Пушкинская карта
Методика оформление. Пушкинская карта Презентация на тему Социальная информатика
Презентация на тему Социальная информатика