Содержание
- 2. Немного истории Понятие об атомах зародилось еще в Древней Греции. Теория была столь же проста сколь
- 3. Разные точки зрения Первое изложение этой теории относится примерно к 400 г. До н.э. и принадлежит
- 4. Если же деление нельзя продолжать бесконечно, рано поздно мы дойдём до мельчайшей частички, которую Демокрит назвал
- 5. Британский химик Роберт Бойль (1627 – 1691) выдвинул предположение, что материя состоит их неких первичных частиц,
- 6. Модели атомов «пудинг с изюмом» - предложил на грани ХIХ и ХХ веков английский ученый Дж.
- 7. В 1932 году английский физик Джеймс Чедвик (1891 – 1974) создал новую модель. Хоть она и
- 8. Соединение атомов Ковалентные соединения: при образовании ковалентных соединений атомы различных элементов делятся друг с другом своими
- 9. Такая разная материя Твердые тела, жидкости и газы – это различные агрегатные состояния вещества. Вещество не
- 10. Газообразное состояние вещества Газы не имеют собственной формы и объёма и, как правило, смешиваются друг с
- 11. Конденсированное состояние вещества К конденсированным системам относятся жидкости и твердые тела. В жидкостях и твердых телах
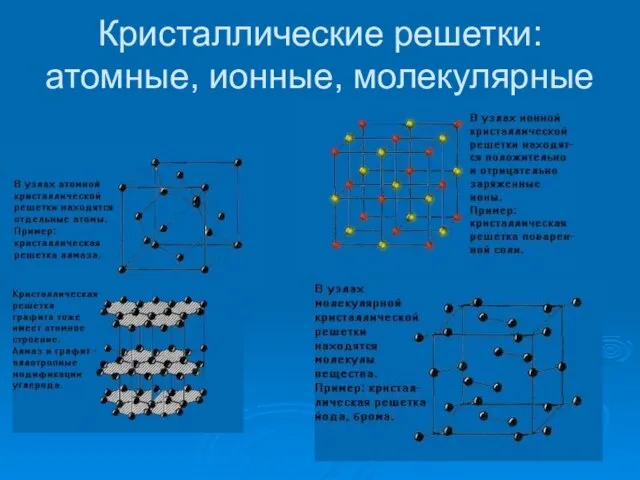
- 12. Кристаллические решетки: атомные, ионные, молекулярные
- 14. Скачать презентацию










 ООО «ЭкоЛайф 69»
ООО «ЭкоЛайф 69» Борьба Руси с иноземным нашествием в XIII в.
Борьба Руси с иноземным нашествием в XIII в. Формы и методы развития исследовательских способностей
Формы и методы развития исследовательских способностей Подбор, обучение и мониторинг персонала Call центров.
Подбор, обучение и мониторинг персонала Call центров. Наследственное право РФ
Наследственное право РФ Приготовление пресного сдобного теста и изделий из него
Приготовление пресного сдобного теста и изделий из него Парковая зона театра им. Натальи Сац
Парковая зона театра им. Натальи Сац правда и вымыслы об акулах
правда и вымыслы об акулах 1. ПР №1 - Тема -1ч. Развитие психики и сознания
1. ПР №1 - Тема -1ч. Развитие психики и сознания Презентация на тему Личные финансы
Презентация на тему Личные финансы Маленькая фея: новинки
Маленькая фея: новинки Настенная живопись
Настенная живопись Комплексное обеспечение процессов в сфере складской логистики, производства и ритейла
Комплексное обеспечение процессов в сфере складской логистики, производства и ритейла Санаторий Марциальные воды в Карелии. Лечение, отдых, встречи
Санаторий Марциальные воды в Карелии. Лечение, отдых, встречи Алгоритм психологической организации группы. Лекция 1
Алгоритм психологической организации группы. Лекция 1 МЕНЕДЖМЕНТ
МЕНЕДЖМЕНТ Современные принципы государственной политики в области МСБ: налоговое регулирование, доступ к финансам
Современные принципы государственной политики в области МСБ: налоговое регулирование, доступ к финансам О финансировании медицинских организаций в системе ОМС в 2011 году и перспективах перехода на одноканальное финансирование в 2011-201
О финансировании медицинских организаций в системе ОМС в 2011 году и перспективах перехода на одноканальное финансирование в 2011-201 Выборы президента школы
Выборы президента школы Оценка информированности учащихся ГБОУ СОШ № 499 по проблемам, связанным с потреблением наркотиков
Оценка информированности учащихся ГБОУ СОШ № 499 по проблемам, связанным с потреблением наркотиков Н.Д. Голев
Н.Д. Голев Продажа маральников и земельных участков
Продажа маральников и земельных участков Автономный контроллер освещения
Автономный контроллер освещения Система управления предприятием Облик-ERP.Конфигурация Оперативное управление предприятием.
Система управления предприятием Облик-ERP.Конфигурация Оперативное управление предприятием. Эмоции эмпатии и вины
Эмоции эмпатии и вины Особенности формирования производственного плана в лесной отрасли
Особенности формирования производственного плана в лесной отрасли Презентация на тему Биологическое действие радиоактивных излучений
Презентация на тему Биологическое действие радиоактивных излучений Школа молодого политика Лидер
Школа молодого политика Лидер