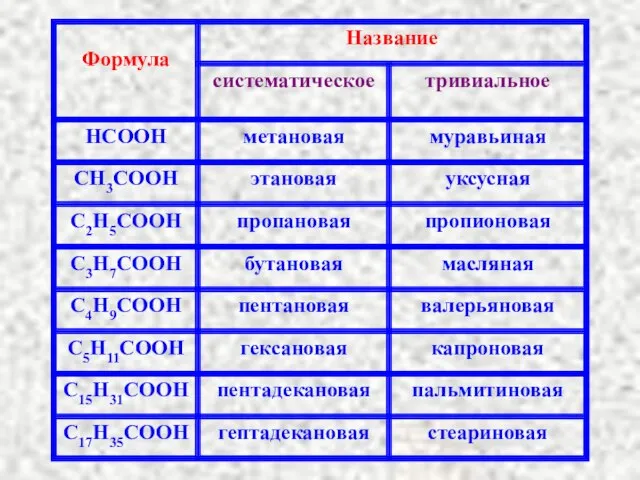
Содержание
- 2. Karboksüülhapped – карбоновые кислоты Rasvhapped - жирные кислоты Aminohapped - аминокислоты Kaksikioon – биполярный ион Piptiidside
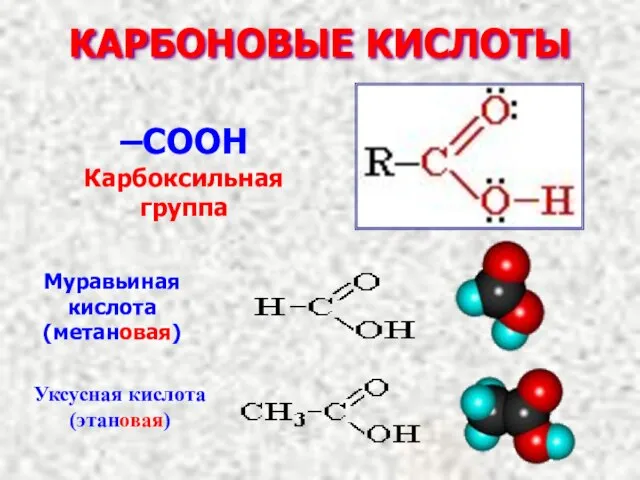
- 3. КАРБОНОВЫЕ КИСЛОТЫ –COOH Карбоксильная группа
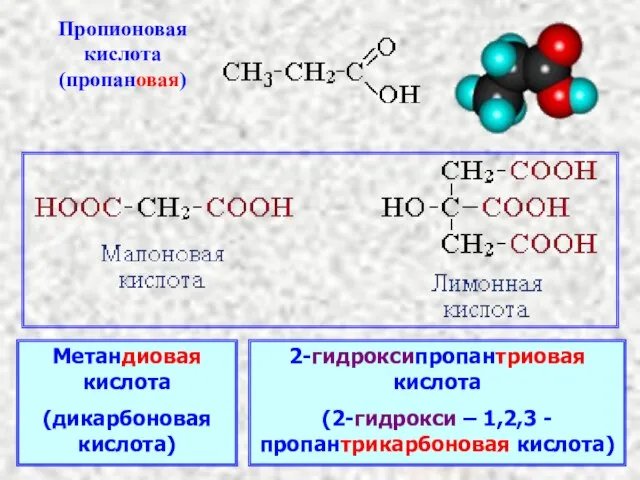
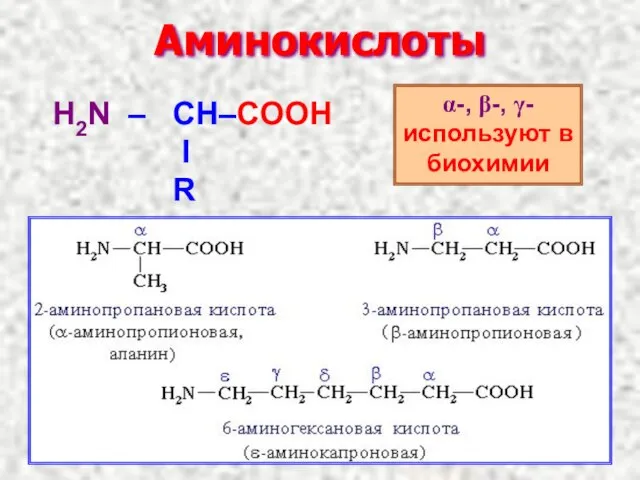
- 4. Метандиовая кислота (дикарбоновая кислота) 2-гидроксипропантриовая кислота (2-гидрокси – 1,2,3 -пропантрикарбоновая кислота)
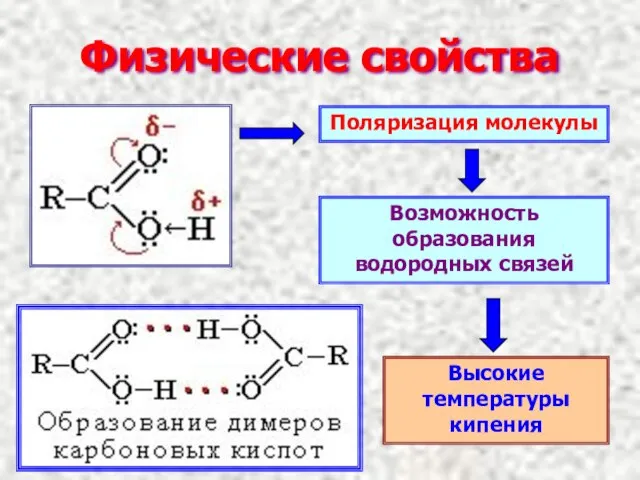
- 6. Физические свойства Поляризация молекулы Возможность образования водородных связей Высокие температуры кипения
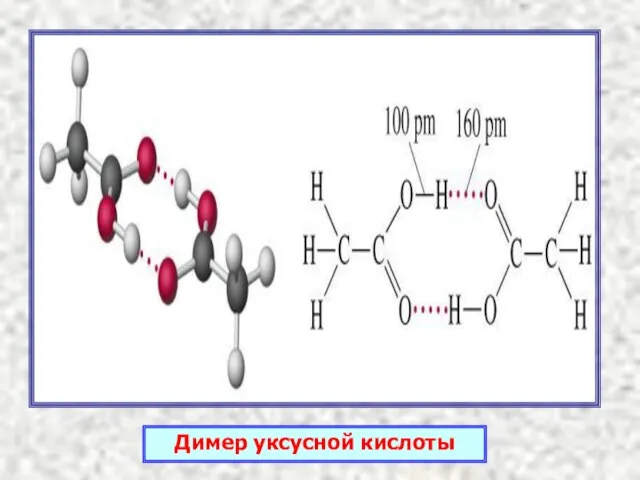
- 7. Димер уксусной кислоты
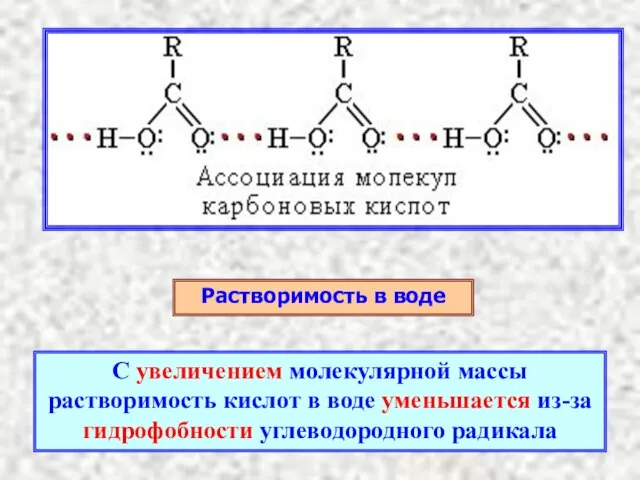
- 8. Растворимость в воде С увеличением молекулярной массы растворимость кислот в воде уменьшается из-за гидрофобности углеводородного радикала
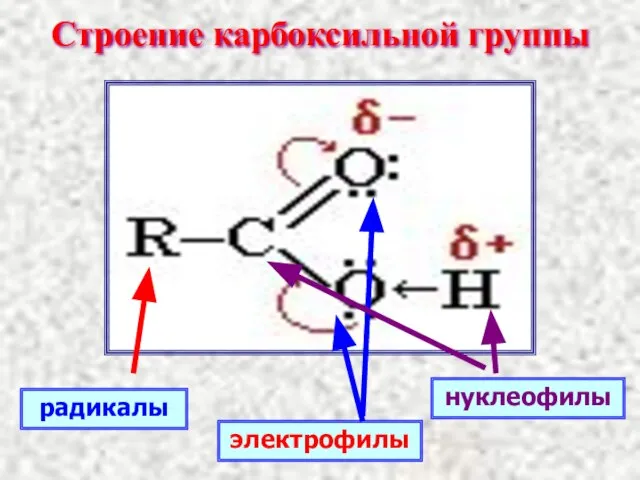
- 9. Строение карбоксильной группы радикалы нуклеофилы электрофилы
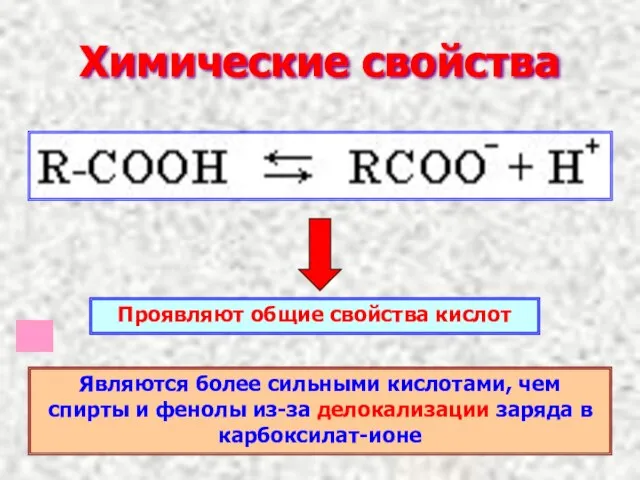
- 10. Химические свойства Проявляют общие свойства кислот Являются более сильными кислотами, чем спирты и фенолы из-за делокализации
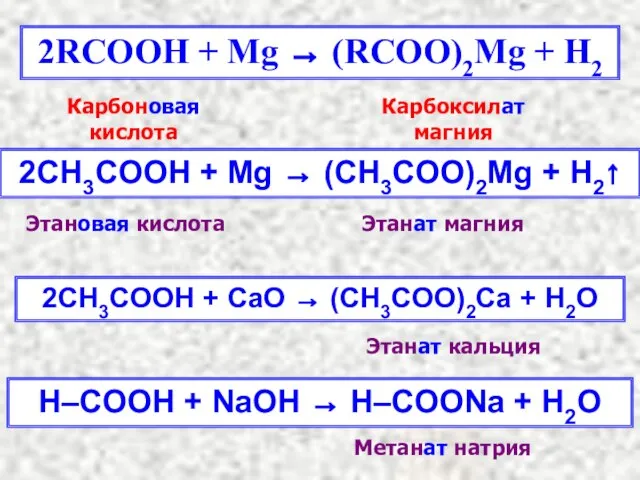
- 11. 2RCOOH + Mg → (RCOO)2Mg + H2 2СH3COOH + Mg → (CH3COO)2Mg + H2↑ Карбоновая кислота
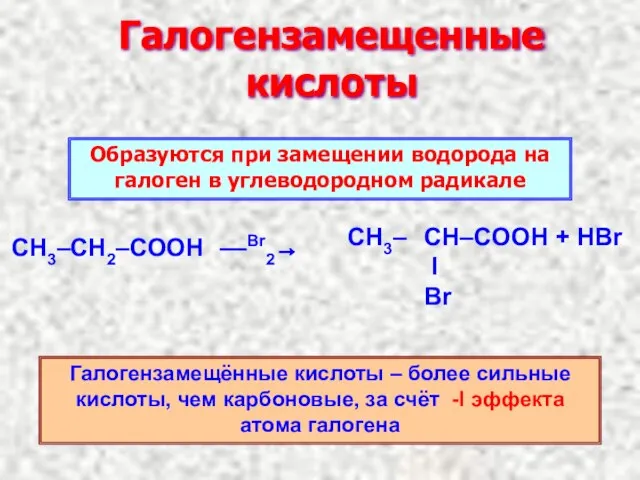
- 12. Галогензамещенные кислоты ––Br2→ Образуются при замещении водорода на галоген в углеводородном радикале Галогензамещённые кислоты – более
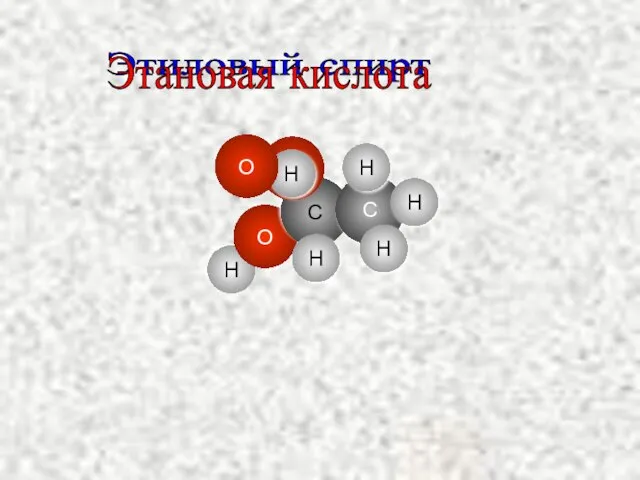
- 13. H O C O C H H H Этиловый спирт H H Этановая кислота O
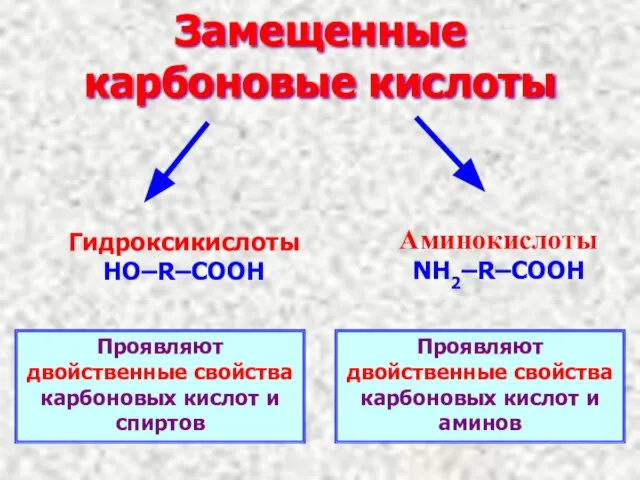
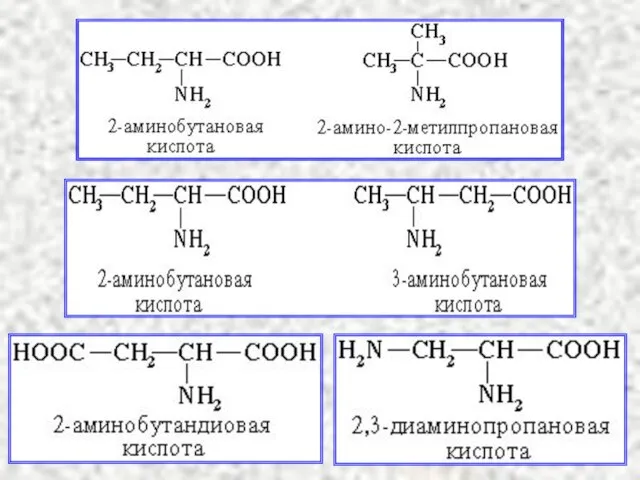
- 14. Замещенные карбоновые кислоты Гидроксикислоты HO–R–COOH Аминокислоты NH2–R–COOH Проявляют двойственные свойства карбоновых кислот и спиртов Проявляют двойственные
- 15. Аминокислоты α-, β-, γ- используют в биохимии
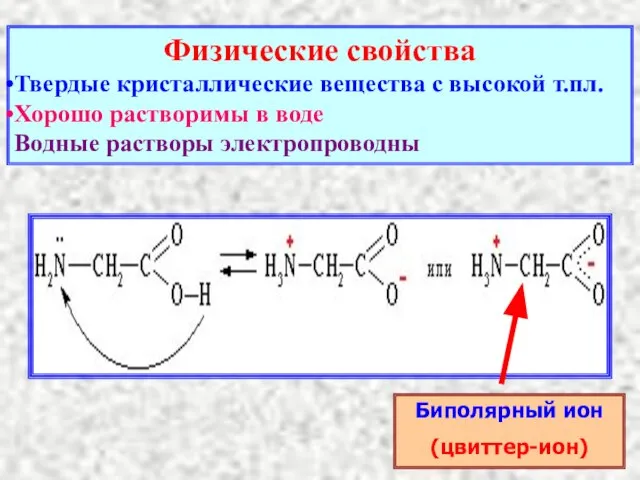
- 17. Физические свойства Твердые кристаллические вещества с высокой т.пл. Хорошо растворимы в воде Водные растворы электропроводны Биполярный
- 18. Химические свойства Аминокислоты являются амфотерными соединениями H2N–CH2–COOH + HCl → Cl− [H3N–CH2–COOH]+ Как основание H2N–CH2–COOH +
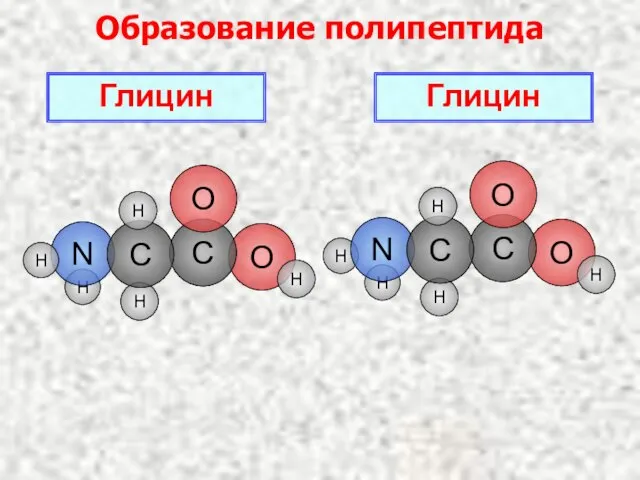
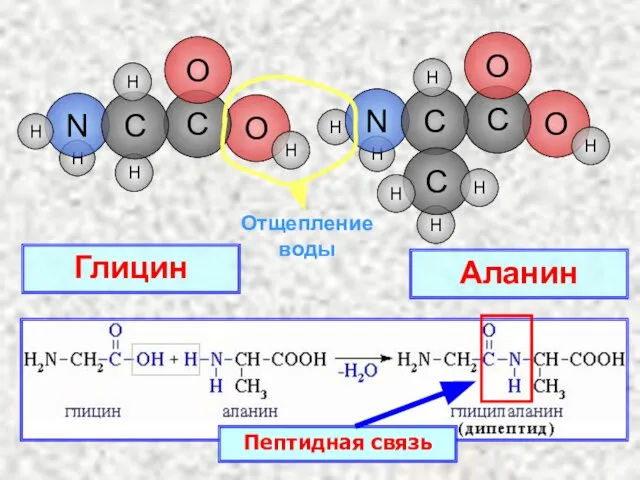
- 19. Образование полипептида Глицин H O H H Глицин
- 20. H O H H H H O C N O C H H C H H
- 22. Скачать презентацию

![Химические свойства Аминокислоты являются амфотерными соединениями H2N–CH2–COOH + HCl → Cl− [H3N–CH2–COOH]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361878/slide-17.jpg)
 Железные дороги России
Железные дороги России Us posters
Us posters Поляков Е.А. Презентация. Психокоррекция
Поляков Е.А. Презентация. Психокоррекция Общие положения. Сигналы на железнодорожном транспорте. Общие положения
Общие положения. Сигналы на железнодорожном транспорте. Общие положения ист мед
ист мед О результатах работы бокса ЦУР Бизнес
О результатах работы бокса ЦУР Бизнес Понятие признаки и виды правоохранительных органов
Понятие признаки и виды правоохранительных органов Презентация на тему Красивые,но смертельно опасные цветы
Презентация на тему Красивые,но смертельно опасные цветы  Ядерный реактор. Принцип работы ядерного реактора
Ядерный реактор. Принцип работы ядерного реактора Старскаясредняяобщеобразовательнаяшкола
Старскаясредняяобщеобразовательнаяшкола Образ сказочной птицы в изобразительном и устном фольклоре
Образ сказочной птицы в изобразительном и устном фольклоре Музеи Санкт-Петербурга
Музеи Санкт-Петербурга Как не болеть в детском саду?Подготовительная группаМБОУ СОШ №35 «Непоседы»
Как не болеть в детском саду?Подготовительная группаМБОУ СОШ №35 «Непоседы» Вещь на уроке изобразительного искусства
Вещь на уроке изобразительного искусства Помоги Маше добраться до клада
Помоги Маше добраться до клада Как выполняли арифметические действия в Древнем Риме?
Как выполняли арифметические действия в Древнем Риме? Презентация на тему Портфолио студента
Презентация на тему Портфолио студента Обществознание
Обществознание изучаем алгоритмы
изучаем алгоритмы Книга рекордов Гиннесса
Книга рекордов Гиннесса Менеджеры в организации
Менеджеры в организации  Средства и методики бизнес-анализа
Средства и методики бизнес-анализа  Алкоголь и его влияние на здоровье человека
Алкоголь и его влияние на здоровье человека Туризм в России: каталог святынь Красногвардейского района Белгородской области
Туризм в России: каталог святынь Красногвардейского района Белгородской области Психоаналитические теории. Питер Блос
Психоаналитические теории. Питер Блос Презентация на тему Контроль за распространением инфекции
Презентация на тему Контроль за распространением инфекции  Игры с дополненной реальностью и вебкам игры
Игры с дополненной реальностью и вебкам игры Вопросы тарифного регулирования в теплоэнергетике и коммунальном комплексе в 2012 – 2013 годах.
Вопросы тарифного регулирования в теплоэнергетике и коммунальном комплексе в 2012 – 2013 годах.