Содержание
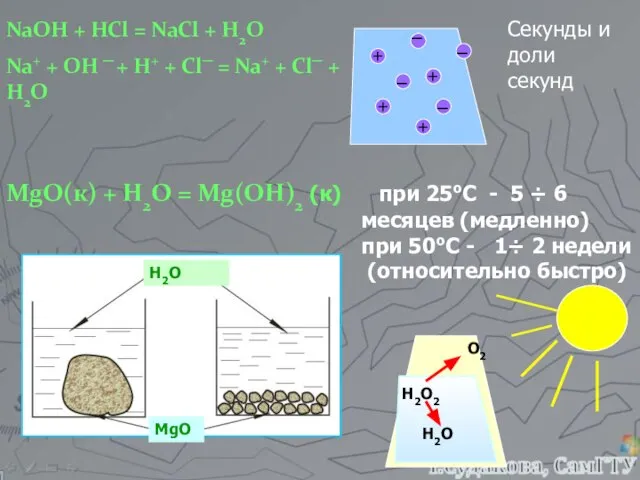
- 2. NaOH + HCl = NaCl + H2O Na+ + OH ─ + H+ + Cl─ =
- 3. Время протекания реакции скорость реакции кинетика «kinẽtikos”, что означает “движущийся”. Кинетика – раздел физической химии, изучающий
- 4. аА + bB → cC + dD, где а, b, c, d – стехиометрические коэффициенты реагентов
- 5. Гомогенные реакции – реакции, в которых все реагенты находятся в одном агрегатном состоянии разложение 2N2O5 (г)
- 6. Скорость химической реакции определяют экспериментально. По полученным результатам эксперимента строят кинетическую кривую - график изменения концентрации
- 7. Для реакции: А + 2В = 3С υ = Для реакции: H2 + I2 = 2HI
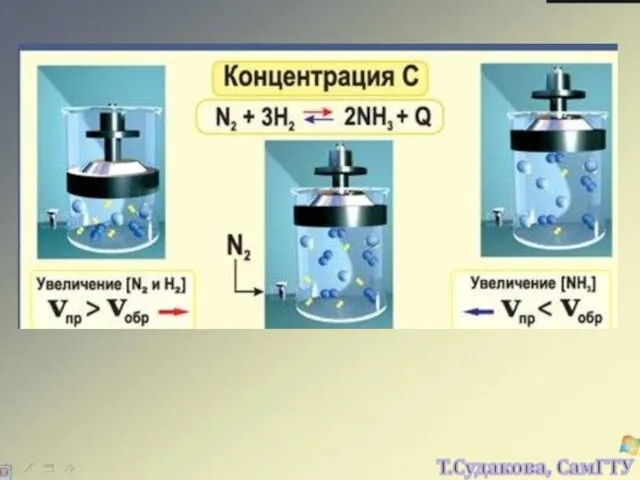
- 8. Факторы, влияющие на скорость реакции: - концентрация реагентов, - температура, - физическое состояние реагентов, - наличие
- 9. Для реакции вида аА + bB = cC закон действующих масс выражается формулой Ʋ = k
- 10. Важное замечание! Концентрация конденсированной фазы не включается в выражение ЗДМ, т.к. она является постоянной величиной. Пример:
- 11. СКОРОСТЬ РЕАКЦИИ МОЖЕТ ЗАВИСЕТЬ ОТ КОНЦЕНТРАЦИЙ ОБОИХ РЕАГЕНТОВ, ИЛИ ТОЛЬКО ОТ КОНЦЕНТРАЦИИ ОДНОГО РЕАГЕНТА, А МОЖЕТ
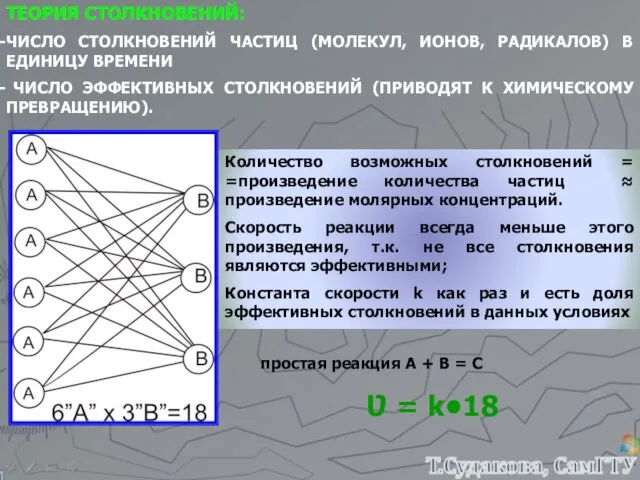
- 12. ТЕОРИЯ СТОЛКНОВЕНИЙ: ЧИСЛО СТОЛКНОВЕНИЙ ЧАСТИЦ (МОЛЕКУЛ, ИОНОВ, РАДИКАЛОВ) В ЕДИНИЦУ ВРЕМЕНИ ЧИСЛО ЭФФЕКТИВНЫХ СТОЛКНОВЕНИЙ (ПРИВОДЯТ К
- 13. ЗАВИСИМОСТЬ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ: ЭМПИРИЧЕСКОЕ ПРАВИЛО ВАНТ-ГОФФА Ʋ2/Ʋ1 = γΔt/10, Δt = T2 –T1 Ʋ2 =
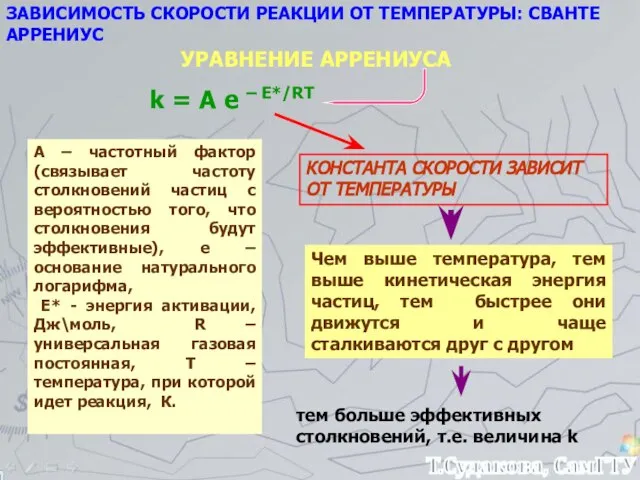
- 14. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ: СВАНТЕ АРРЕНИУС УРАВНЕНИЕ АРРЕНИУСА k = А е – Е*/RT КОНСТАНТА
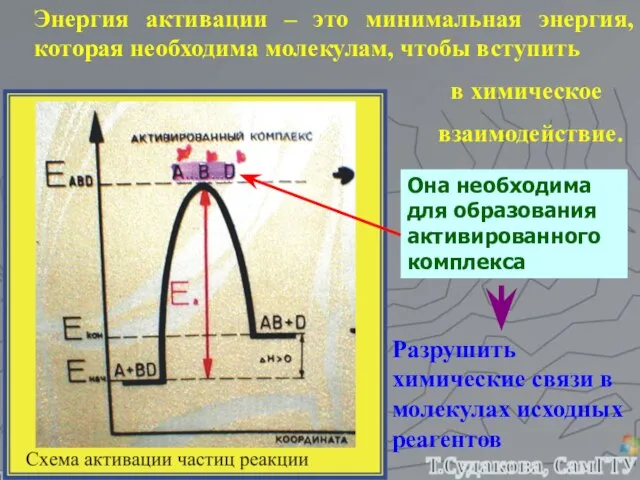
- 15. Энергия активации – это минимальная энергия, которая необходима молекулам, чтобы вступить в химическое взаимодействие. Она необходима
- 16. Согласно простой теории столкновений: Скорость = частота столкновений • Вероятность, что Е ≥Еа Математически: Скорость реакции
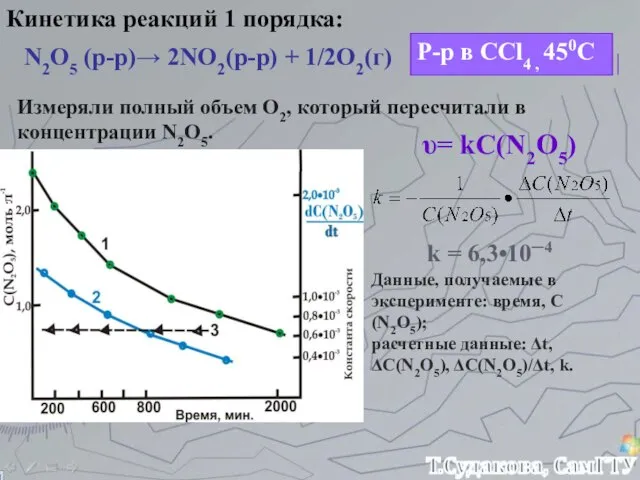
- 17. Кинетика реакций 1 порядка: N2O5 (р-р)→ 2NO2(р-р) + 1/2O2(г) Р-р в CCl4 , 450С Измеряли полный
- 18. В общем случае в теории: υ = -ln C = kt + const t=0, C=C0, const=
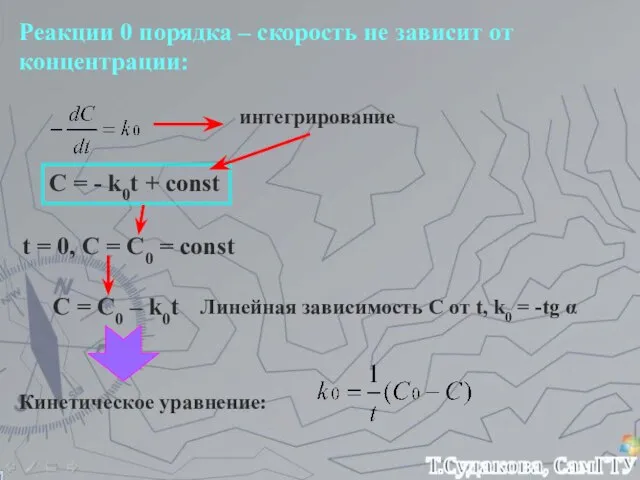
- 19. Реакции 0 порядка – скорость не зависит от концентрации: интегрирование C = - k0t + const
- 20. Реакции 2 порядка: С1 и С2 – концентрации реагентов в момент времени t. Если С1 =
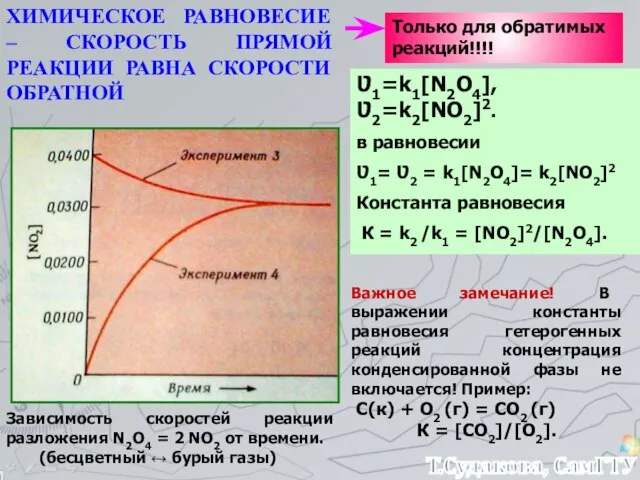
- 21. Зависимость скоростей реакции разложения N2О4 = 2 NО2 от времени. (бесцветный ↔ бурый газы) ХИМИЧЕСКОЕ РАВНОВЕСИЕ
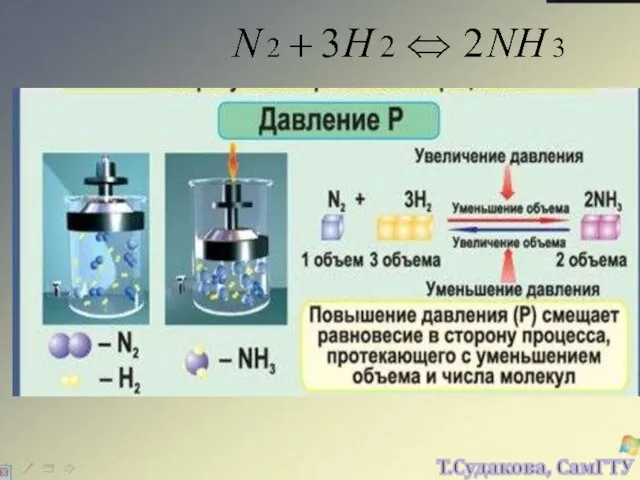
- 22. Изменение любого фактора, могущего влиять на состояние химического равновесия, вызывает в системе реакцию, стремящуюся противодействовать производимому
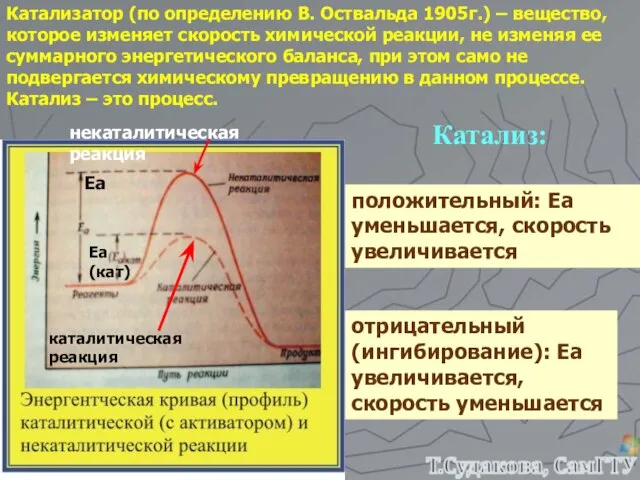
- 26. Катализатор (по определению В. Оствальда 1905г.) – вещество, которое изменяет скорость химической реакции, не изменяя ее
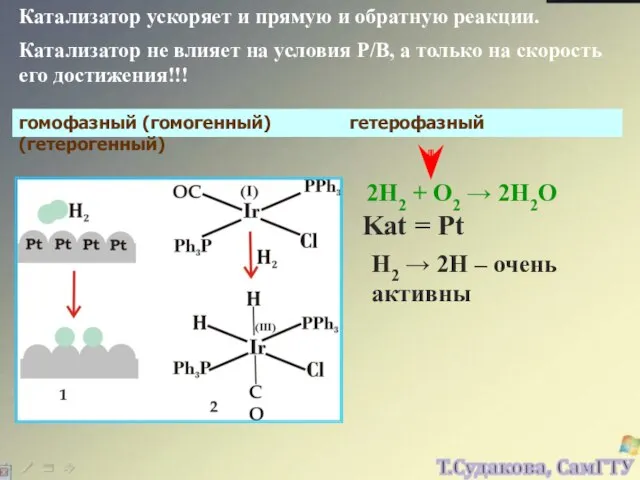
- 27. Катализатор ускоряет и прямую и обратную реакции. Катализатор не влияет на условия Р/В, а только на
- 29. Скачать презентацию















 Программные продукты серии Retail
Программные продукты серии Retail Война и мир Толстого
Война и мир Толстого Влияние информационных технологийна повышение безопасности пациентовна примере примененияклинической информационной системы
Влияние информационных технологийна повышение безопасности пациентовна примере примененияклинической информационной системы ГИА по русскому языку: как писать сочинение
ГИА по русскому языку: как писать сочинение Кафе Македония
Кафе Македония Горные экосистемы (2 класс)
Горные экосистемы (2 класс) Наречие 10 класс
Наречие 10 класс Великая Отечественная война.
Великая Отечественная война. Рижская Гимназия «Золитуде»Научно-исследовательская работа по литературеСетература: замена печатным изданиям?
Рижская Гимназия «Золитуде»Научно-исследовательская работа по литературеСетература: замена печатным изданиям? На какую систему налогообложения перейти?
На какую систему налогообложения перейти? Национальный вопрос в современной России
Национальный вопрос в современной России Не тяговый подвижной состав. Вагонное хозяйство
Не тяговый подвижной состав. Вагонное хозяйство урок 5. Небесные координаты и звёздные карты
урок 5. Небесные координаты и звёздные карты Как быстрее запомнить алфавит
Как быстрее запомнить алфавит КАТАЛОГ ПРОДУКЦИИ
КАТАЛОГ ПРОДУКЦИИ Православие в России и Донбассе
Православие в России и Донбассе В рамках программы Германской службы академических обменов (DAAD)
В рамках программы Германской службы академических обменов (DAAD) HOBBY OF STAMP COLLECTING
HOBBY OF STAMP COLLECTING Ключевые тренды развития доменной индустрии в России Национализация и расширение адресного пространства Что год грядущий на
Ключевые тренды развития доменной индустрии в России Национализация и расширение адресного пространства Что год грядущий на Разработка технических решений по защите от утечек нефти в колодцах отбора давления
Разработка технических решений по защите от утечек нефти в колодцах отбора давления ШУМЕРСКИЕ ТАБЛИЧКИ
ШУМЕРСКИЕ ТАБЛИЧКИ Химические раскопки по классам неорганических соединений
Химические раскопки по классам неорганических соединений Структура экосистем
Структура экосистем People Must Be Clever with Animals
People Must Be Clever with Animals Devicom -сетевое управление обогревом
Devicom -сетевое управление обогревом Презентация на тему Тревожные дети
Презентация на тему Тревожные дети Умная надежная программа
Умная надежная программа Курс: инженерный анализ в системе конечно-элементного анализа ANSYS
Курс: инженерный анализ в системе конечно-элементного анализа ANSYS