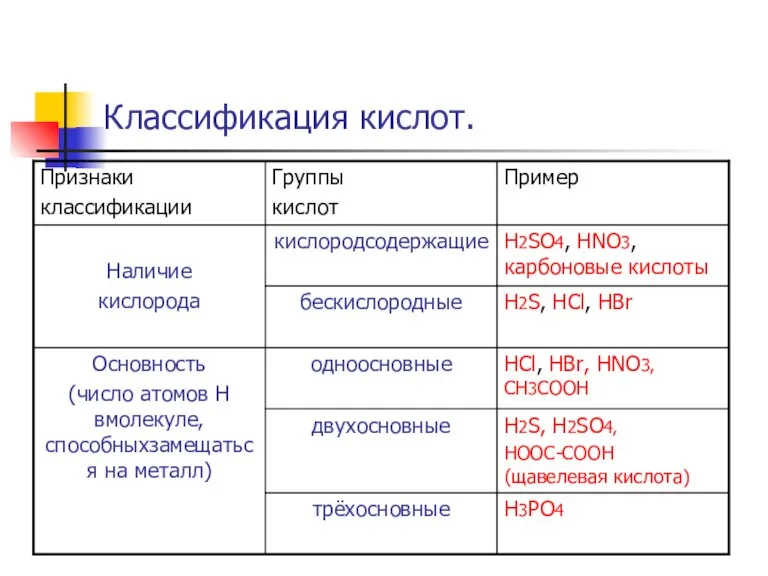
Слайд 2Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на

атомы металлов, и кислотных остатков.
Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
Слайд 3По определению Льюиса, кислота — это электролит(вещество, участвующее в реакциях с переходом

электрона), принимающий электронную пару в реакции с основанием, то есть веществом, отдающим электронную пару.
В теории Бренстеда-Лоури, кислота — вещество, отдающее протон (основание — вещество, принимающее протон).
Слайд 4В рамках теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации
которого из катионов образуются лишь катионы водорода.
Слайд 9Взаимодействие с нерастворимыми основаниямиВзаимодействие с нерастворимыми основаниями с образованием солиВзаимодействие с нерастворимыми

основаниями с образованием соли и водыВзаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
Cu(OH)2 + H2SO4 = CuSO4 + H2O
Слайд 10Взаимодействие с солямиВзаимодействие с солями, если выпадает осадокВзаимодействие с солями, если выпадает

осадок или выделяется газ:
BaCl2 + H2SO4 = BaSO4 + 2HCl
Металлы, стоящие в ряду активностиМеталлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты
Mg + 2HCl = MgCl2 + H2
Слайд 11Для органических кислот характерна реакция этерификации
CH3COOH + C2H5OH = CH3COOC2H5 +
H2O








 Стипендия Правительства области
Стипендия Правительства области المالية االستدامة المالية
المالية االستدامة المالية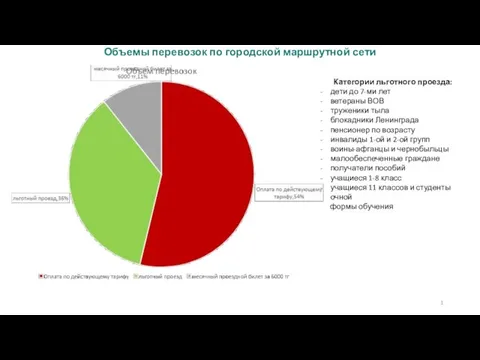 Объемы перевозок по городской маршрутной сети
Объемы перевозок по городской маршрутной сети День инвалида
День инвалида Презентация на тему Интернет и его возможности
Презентация на тему Интернет и его возможности Extenzionálne modely. Algebraická teória. Transformácie intervalov. Definícia funkcie Glob. (Téma 5)
Extenzionálne modely. Algebraická teória. Transformácie intervalov. Definícia funkcie Glob. (Téma 5) Культура Древней Греции
Культура Древней Греции Штриховая гладь
Штриховая гладь Профессия Повар-кондитер
Профессия Повар-кондитер Организационное стимулирование. Условия для внедрения мотивации персонала
Организационное стимулирование. Условия для внедрения мотивации персонала Что такое бенилюкс?
Что такое бенилюкс? Презентация на тему Здоровьесберегающие технологии на уроках в начальной школе. Окружающий мир 3 класс
Презентация на тему Здоровьесберегающие технологии на уроках в начальной школе. Окружающий мир 3 класс  FOOD SAFETY
FOOD SAFETY  Ассирия
Ассирия Презентация на тему Кометы и метеоры
Презентация на тему Кометы и метеоры Руководство Ernst&Young по составления бизнес-планов
Руководство Ernst&Young по составления бизнес-планов Куклы из махровых носков
Куклы из махровых носков Конституционные суды Приволжского Федерального округа
Конституционные суды Приволжского Федерального округа Японская каллиграфия - диалог культур Токио - Красноярск
Японская каллиграфия - диалог культур Токио - Красноярск «Пилот»: Маркетинг в компании
«Пилот»: Маркетинг в компании Устный журнал. В мире имён и названий
Устный журнал. В мире имён и названий Баскетбол. Тест по физической культуре
Баскетбол. Тест по физической культуре Материаловедение 5-6р
Материаловедение 5-6р Применение приборов серии IVS для решения задач вибродиагностики
Применение приборов серии IVS для решения задач вибродиагностики Композиционное решение для предприятий автомобилестроительной отрасли на основе системы MFG/PRO
Композиционное решение для предприятий автомобилестроительной отрасли на основе системы MFG/PRO Никола Тесла-повелитель молний
Никола Тесла-повелитель молний Проверка понимания озвученного текста
Проверка понимания озвученного текста Представление графической информации в компьютере
Представление графической информации в компьютере