Содержание
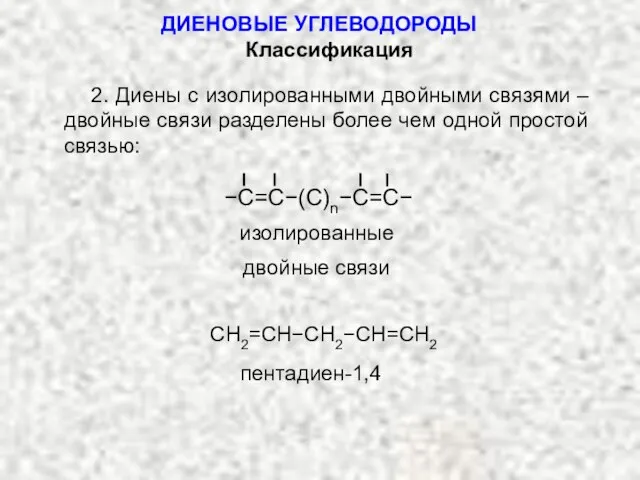
- 2. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ 2. Диены с изолированными двойными связями – двойные связи разделены более чем одной простой
- 3. 3. Диены с непосредственно примыкающими друг к другу двойными связями – кумулированые двойные связи (аллены): CH2=C=CH2
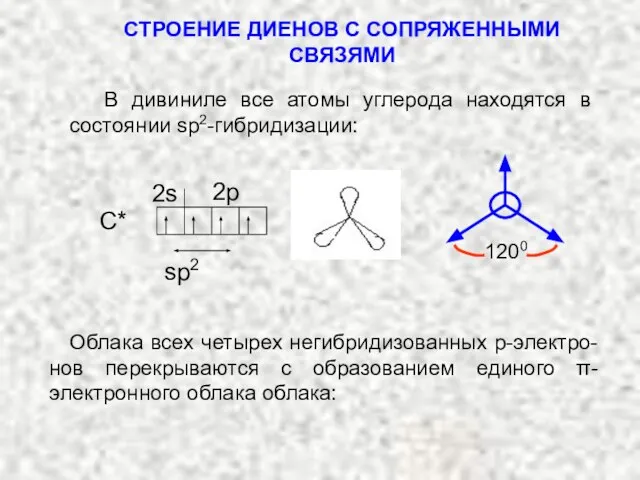
- 4. В дивиниле все атомы углерода находятся в состоянии sp2-гибридизации: 1200 Облака всех четырех негибридизованных р-электро-нов перекрываются
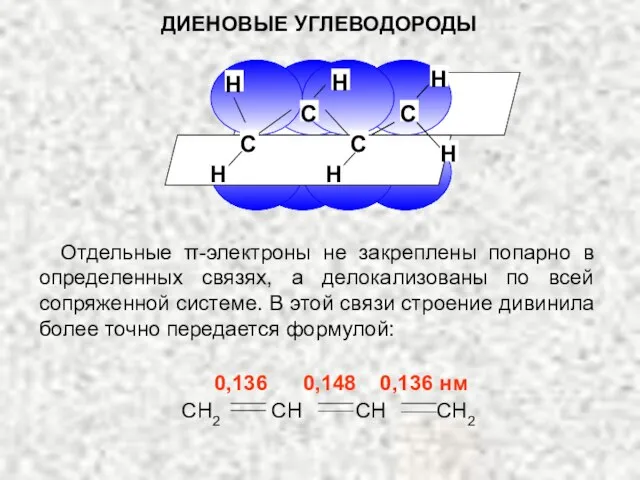
- 5. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ Отдельные π-электроны не закреплены попарно в определенных связях, а делокализованы по всей сопряженной системе.
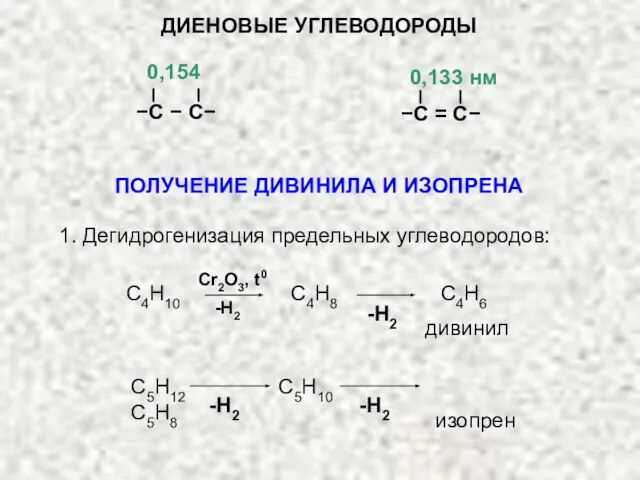
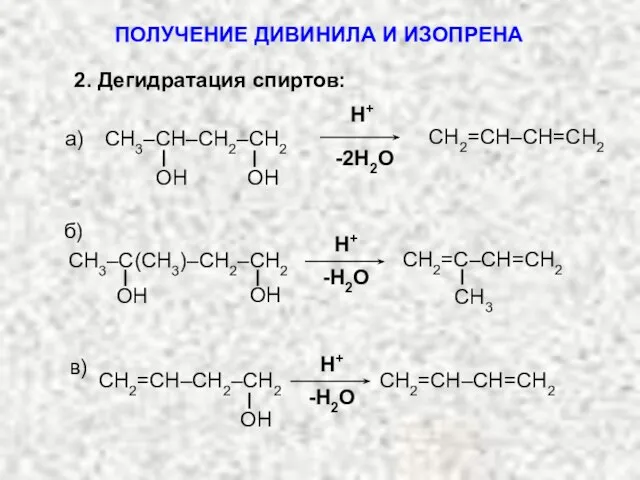
- 6. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ 0,154 −С − С− 0,133 нм −С = С− ПОЛУЧЕНИЕ ДИВИНИЛА И ИЗОПРЕНА 1.
- 7. H+ -2H2O CH2=CH–CH=CH2 OH OH СH3–CH–CH2–CH2 а) -H2O CH3 CH2=C–CH=CH2 OH OH CH3–C(CH3)–CH2–CH2 H+ CH2=CH–CH=CH2 OH
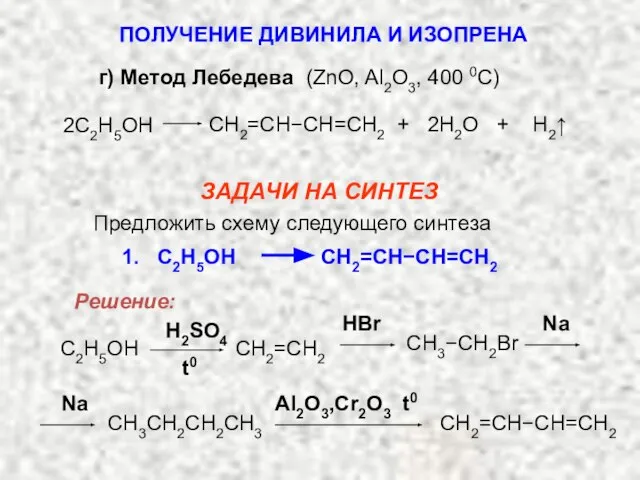
- 8. г) Метод Лебедева (ZnO, Al2O3, 400 0C) СH2=CH−CH=CH2 + 2H2O + H2↑ 2C2H5OH ЗАДАЧИ НА СИНТЕЗ
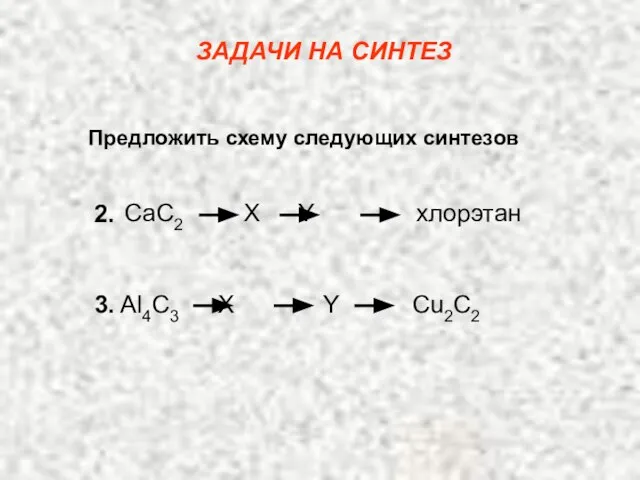
- 9. Предложить схему следующих синтезов ЗАДАЧИ НА СИНТЕЗ CaC2 X Y хлорэтан 2. 3. Al4C3 X Y
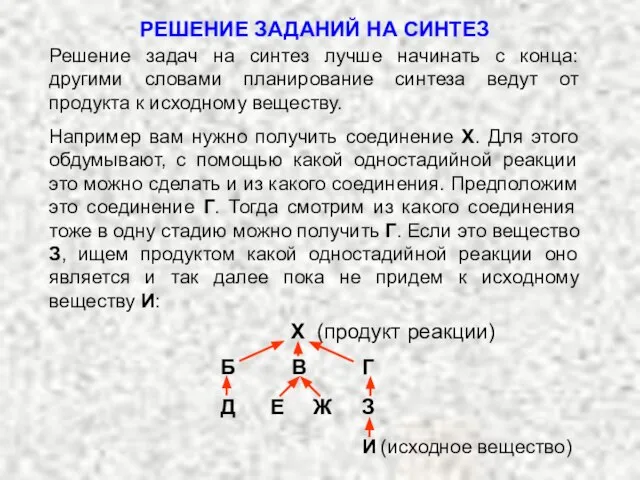
- 10. РЕШЕНИЕ ЗАДАНИЙ НА СИНТЕЗ Решение задач на синтез лучше начинать с конца: другими словами планирование синтеза
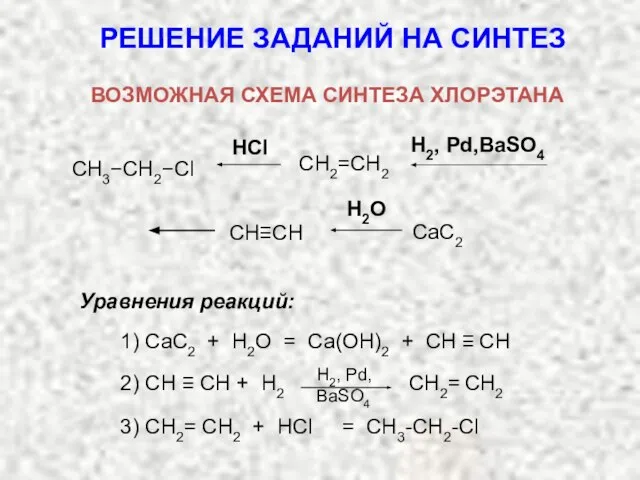
- 11. HCl H2, Pd,BaSO4 CH2=CH2 CH3−CH2−Cl H2O CaC2 CH≡CH РЕШЕНИЕ ЗАДАНИЙ НА СИНТЕЗ ВОЗМОЖНАЯ СХЕМА СИНТЕЗА ХЛОРЭТАНА
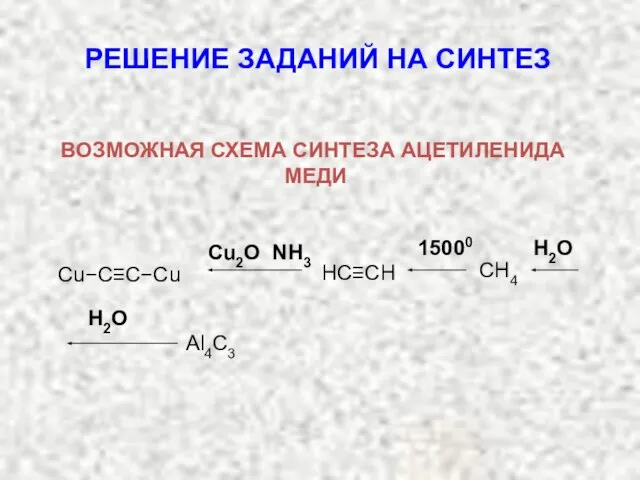
- 12. Cu2O NH3 15000 H2O CH4 HC≡CH Cu−C≡C−Cu РЕШЕНИЕ ЗАДАНИЙ НА СИНТЕЗ ВОЗМОЖНАЯ СХЕМА СИНТЕЗА АЦЕТИЛЕНИДА МЕДИ
- 13. ХИМИЧЕСКИЕ СВОЙСТВА ДИЕНОВ Типичными реакциями для диенов, как и для алкенов являются реакции электрофильного присоединения. При
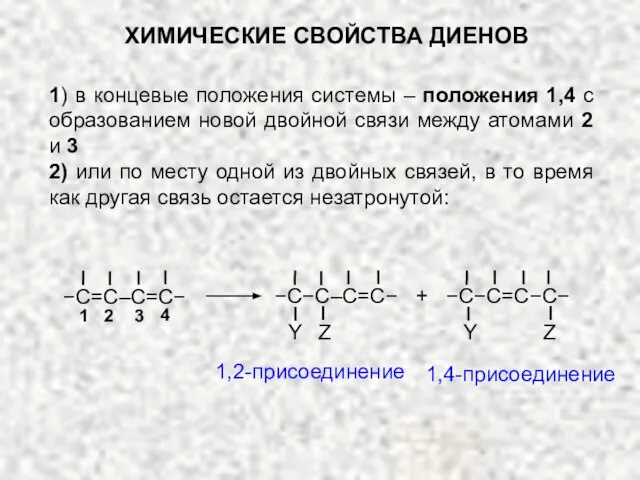
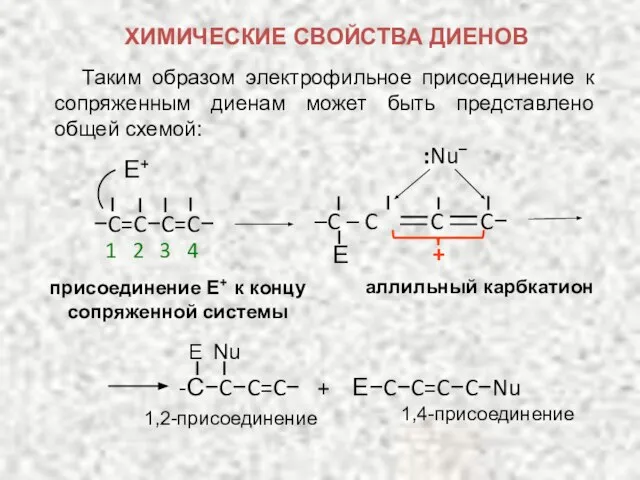
- 14. 1,2-присоединение 1,4-присоединение Z Y + −C−C=C−C− Z Y −C−C–C=C− −C=C–C=C− ХИМИЧЕСКИЕ СВОЙСТВА ДИЕНОВ 1) в концевые
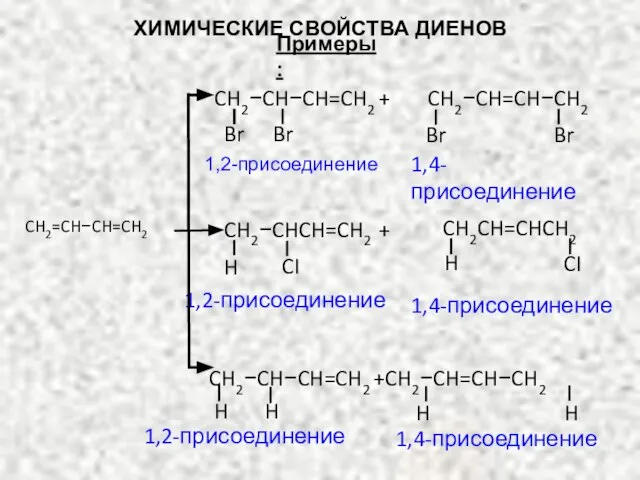
- 15. Примеры: CH2=CH−CH=CH2 1,2-присоединение 1,4-присоединение 1,2-присоединение 1,4-присоединение 1,2-присоединение 1,4-присоединение CH2−CH−CH=CH2 + Br Br CH2−CH=CH−CH2 Br Br H
- 16. Механизм электрофильного присоединения к диенам Ранее было показано, что электрофильное присоеди-нение представляет собой двухстадийный процесс и
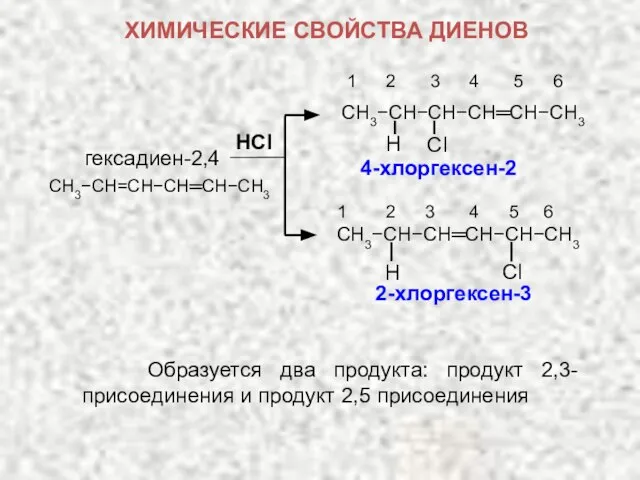
- 17. HСl гексадиен-2,4 4-хлоргексен-2 1 2 3 4 5 6 CH3−CH−CH−CH═CH−CH3 Сl H 2-хлоргексен-3 1 2 3
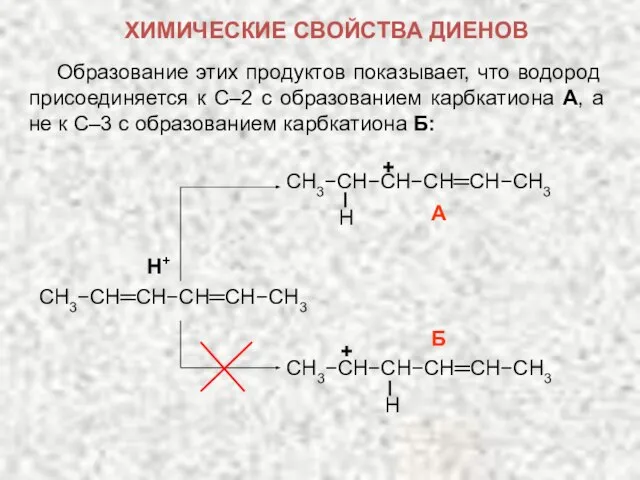
- 18. Образование этих продуктов показывает, что водород присоединяется к С–2 с образованием карбкатиона А, а не к
- 19. Оба карбкатиона являются вторичными, но А устойчивее, чем Б. Карбкатион А является не просто вторичным карбкатионом:
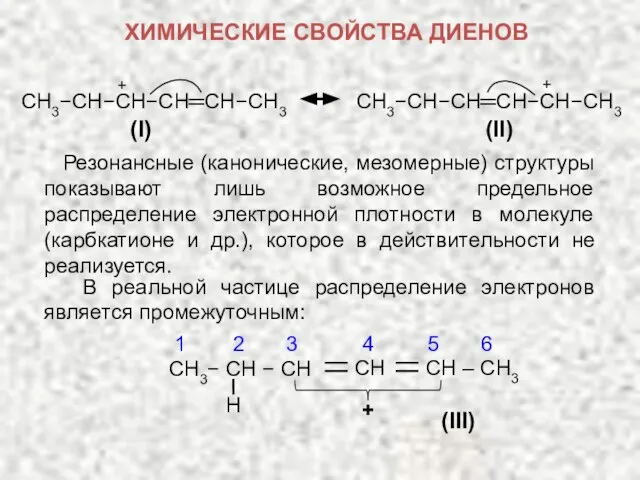
- 20. CH3−CH−CH−CH═CH−CH3 (I) CH3−CH−CH═CH−CH−CH3 (II) Резонансные (канонические, мезомерные) структуры показывают лишь возможное предельное распределение электронной плотности в
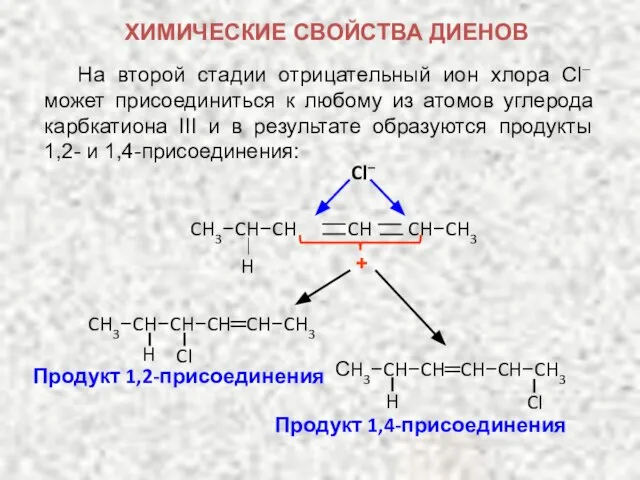
- 21. На второй стадии отрицательный ион хлора Cl– может присоединиться к любому из атомов углерода карбкатиона III
- 22. Таким образом электрофильное присоединение к сопряженным диенам может быть представлено общей схемой: присоединение Е+ к концу
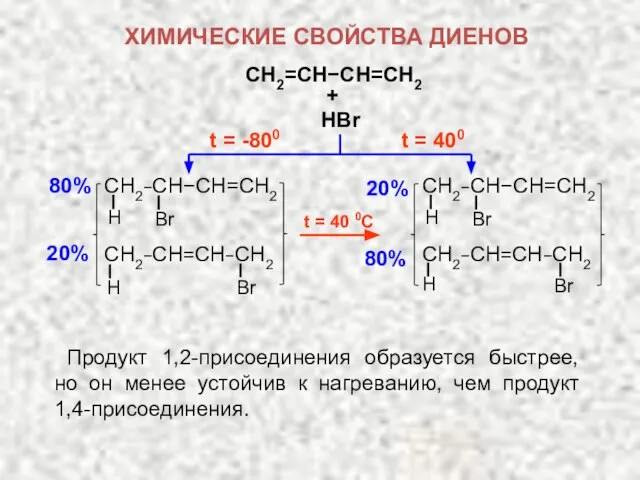
- 23. 20% t = 40 0C 80% Продукт 1,2-присоединения образуется быстрее, но он менее устойчив к нагреванию,
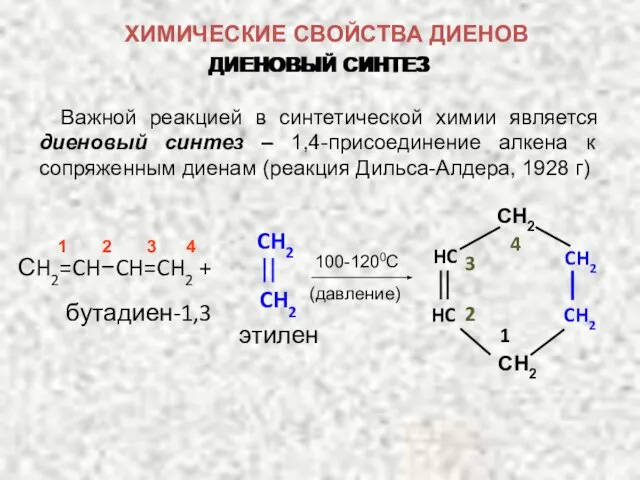
- 24. ДИЕНОВЫЙ СИНТЕЗ Важной реакцией в синтетической химии является диеновый синтез – 1,4-присоединение алкена к сопряженным диенам
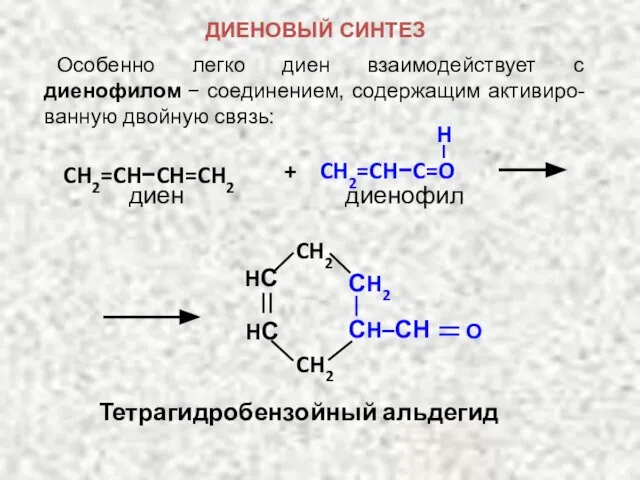
- 25. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ Особенно легко диен взаимодействует с соедиением, содержащим активированную двойную связь − с диенофилом:
- 26. диенофил диен H + CH2=CH−C=O CH2=CH−CH=CH2 Тетрагидробензойный альдегид CH2 CH2 О HС HС СH2 СH–СН ДИЕНОВЫЙ
- 27. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ ПОЛИМЕРИЗАЦИЯ СОПРЯЖЕННЫХ ДИЕНОВ Сравнение алкенов и диенов: n∙ АЛКЕН АЛКАН n∙ ДИЕН продукт с
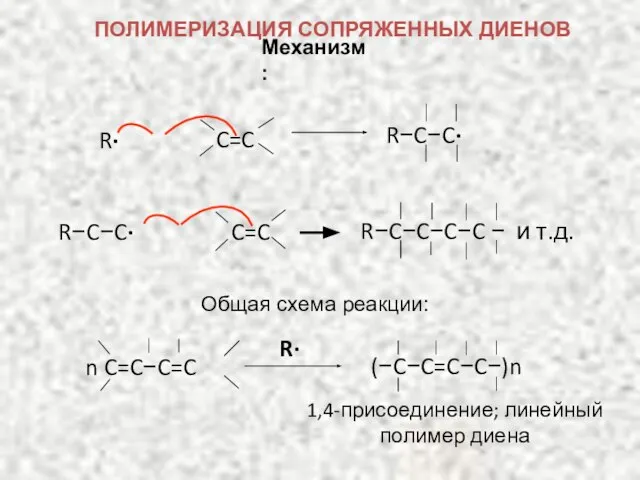
- 28. Механизм: R−C−C∙ R∙ R−C−C−C−C − и т.д. R−C−C∙ Общая схема реакции: 1,4-присоединение; линейный полимер диена (−C−C=C−C−)n
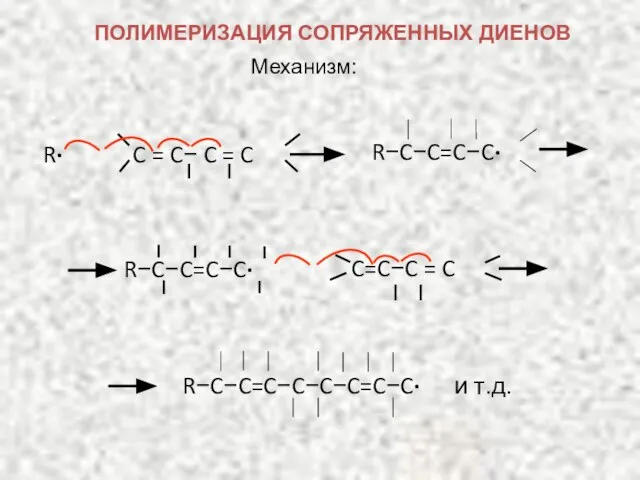
- 29. Механизм: R−C−C=C−C∙ R∙ C = C− C = C C=C−C = C R−C−C=C−C∙ ПОЛИМЕРИЗАЦИЯ СОПРЯЖЕННЫХ ДИЕНОВ
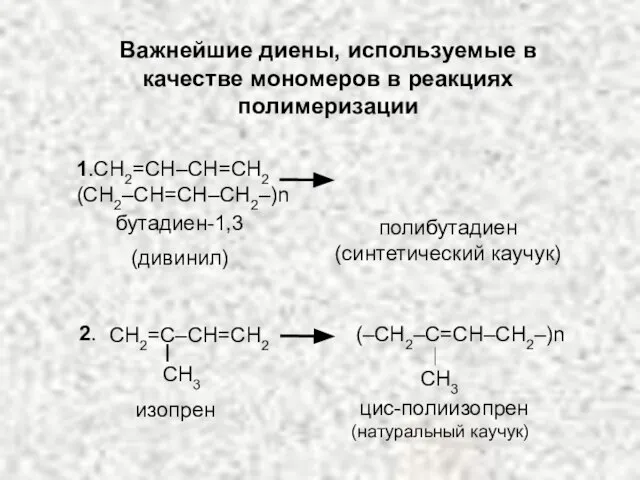
- 30. Важнейшие диены, используемые в качестве мономеров в реакциях полимеризации 1.СH2=CH–CH=CH2 (CH2–CH=CH–CH2–)n бутадиен-1,3 (дивинил) полибутадиен (синтетический каучук)
- 32. Скачать презентацию






 ВодорастворимыеРастительныеМасла (ВРМ)
ВодорастворимыеРастительныеМасла (ВРМ) Областные особенности русского костюма
Областные особенности русского костюма Проект на тему: Фэн-шуй ( | ) в классной комнате. - презентация
Проект на тему: Фэн-шуй ( | ) в классной комнате. - презентация Панели стеновые CPL
Панели стеновые CPL Подготовка к ЕГЭ. Решение задач на движение
Подготовка к ЕГЭ. Решение задач на движение Презентация замороженных фруктовых пюре и ягод Dira
Презентация замороженных фруктовых пюре и ягод Dira Зеленый наряд нашего города
Зеленый наряд нашего города Техника квиллинг
Техника квиллинг «Атлас флоры и фауны Белого моря» это коллективная монография, подготовленная большой группой специалистов. Книга дает возможнос
«Атлас флоры и фауны Белого моря» это коллективная монография, подготовленная большой группой специалистов. Книга дает возможнос Текхнология блокчейн: инвестиции в будущее
Текхнология блокчейн: инвестиции в будущее Выгода открытия бизнеса в 2020 году
Выгода открытия бизнеса в 2020 году Изменение фоновых картинок в презентациях PowerPoint и текстовом редакторе Word
Изменение фоновых картинок в презентациях PowerPoint и текстовом редакторе Word Романтизм в русской живописи XIX века
Романтизм в русской живописи XIX века Развитие методов синтеза, исследование физико-химических и электрофизических свойств модифицированных наноуглеродных и фторугл
Развитие методов синтеза, исследование физико-химических и электрофизических свойств модифицированных наноуглеродных и фторугл Профи-digest
Профи-digest lecture_5
lecture_5 Виды сказуемых
Виды сказуемых Radiographic Interpretation of Infections of Jaws
Radiographic Interpretation of Infections of Jaws phpm2fa0e_ovosibirskaya-oblast
phpm2fa0e_ovosibirskaya-oblast Итоги 2-й четверти
Итоги 2-й четверти Математика-царица наук?
Математика-царица наук? Экономический смысл налогообложения
Экономический смысл налогообложения Локализация концепции шлюза на примере ОАО Манотомь
Локализация концепции шлюза на примере ОАО Манотомь Презентация на тему Справедливость и равенство
Презентация на тему Справедливость и равенство Protection of environment
Protection of environment Статусы пассажиров. Служебные пассажиры
Статусы пассажиров. Служебные пассажиры Буквы Ч и Щ в суффиксах имён существительных
Буквы Ч и Щ в суффиксах имён существительных Отдыхаем на отлично
Отдыхаем на отлично