Содержание
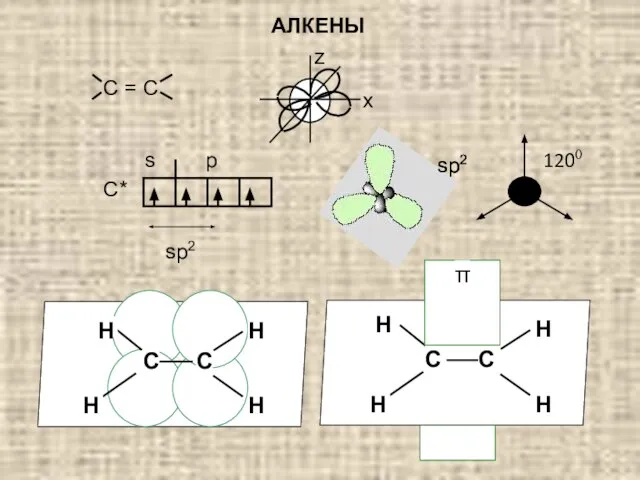
- 2. x z 1200 С* sp2 АЛКЕНЫ sp2 s p
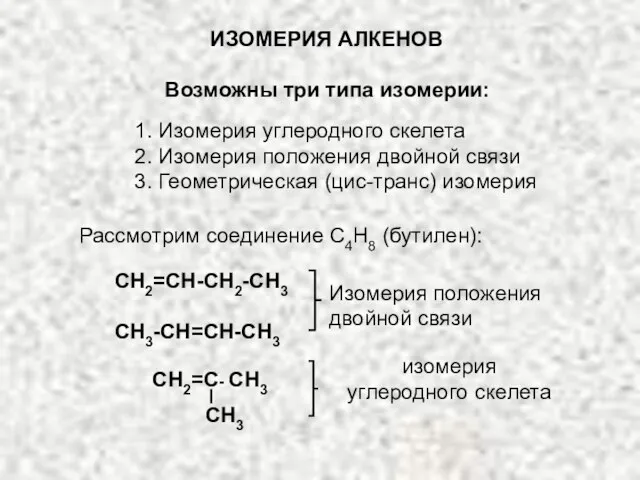
- 3. ИЗОМЕРИЯ АЛКЕНОВ Возможны три типа изомерии: 1. Изомерия углеродного скелета 2. Изомерия положения двойной связи 3.
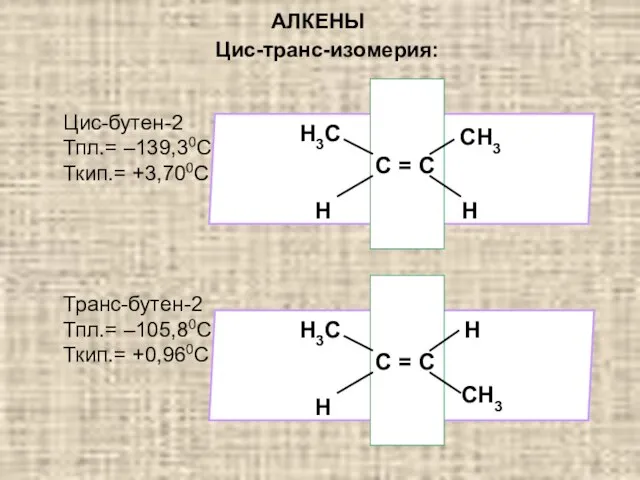
- 4. АЛКЕНЫ Цис-транс-изомерия: Цис-бутен-2 Тпл.= –139,30С Ткип.= +3,700С Транс-бутен-2 Тпл.= –105,80С Ткип.= +0,960С
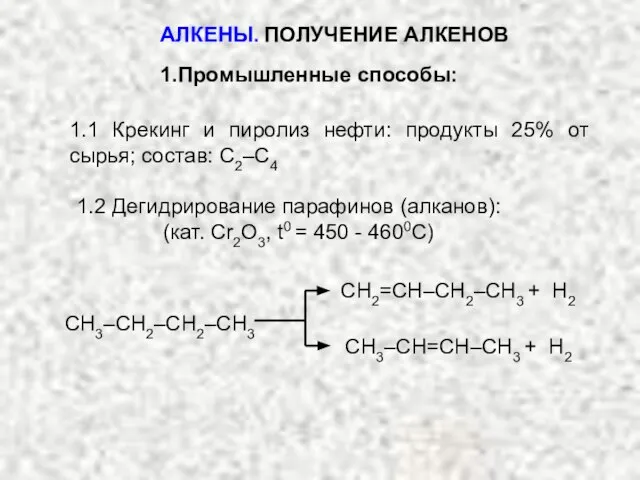
- 5. АЛКЕНЫ. ПОЛУЧЕНИЕ АЛКЕНОВ 1.Промышленные способы: 1.1 Крекинг и пиролиз нефти: продукты 25% от сырья; состав: С2–С4
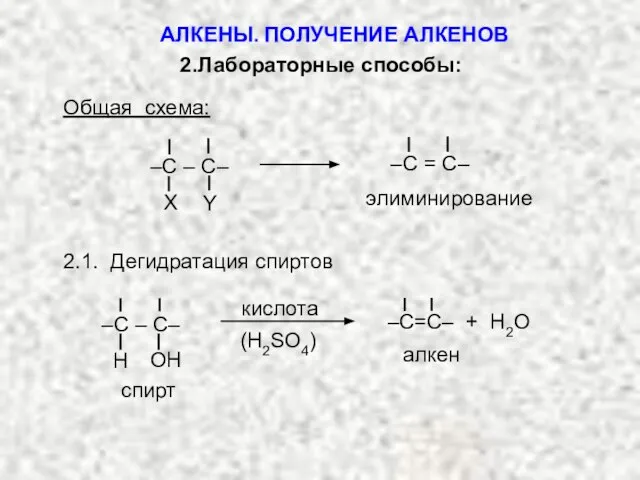
- 6. элиминирование –C = C– X Y –C – C– 2.Лабораторные способы: Общая схема: 2.1. Дегидратация спиртов
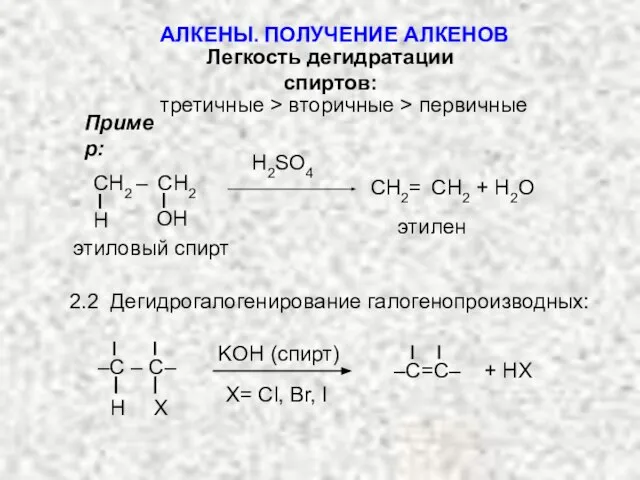
- 7. Легкость дегидратации спиртов: третичные > вторичные > первичные Пример: H2SO4 этиловый спирт ОН Н CH2 –
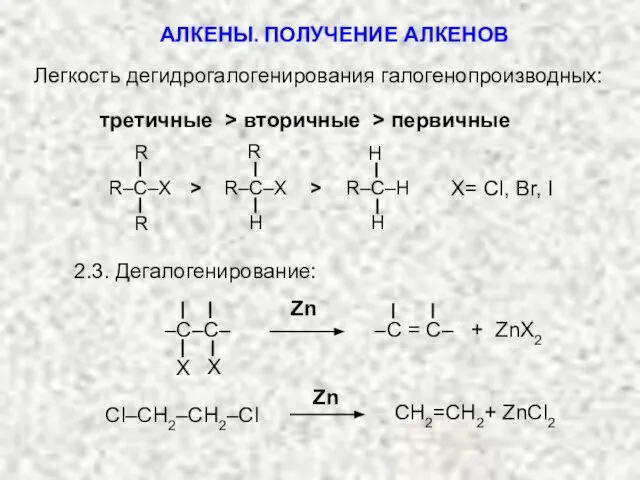
- 8. Легкость дегидрогалогенирования галогенопроизводных: третичные > вторичные > первичные R R R–C–X R H R–C–X H H
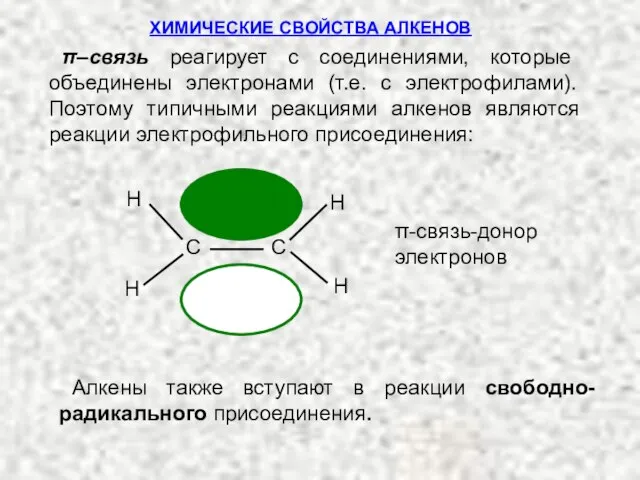
- 9. ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ Типичными реакциями двойной связи являются реакции присоединения, при которых происходит разрыв π-связи и
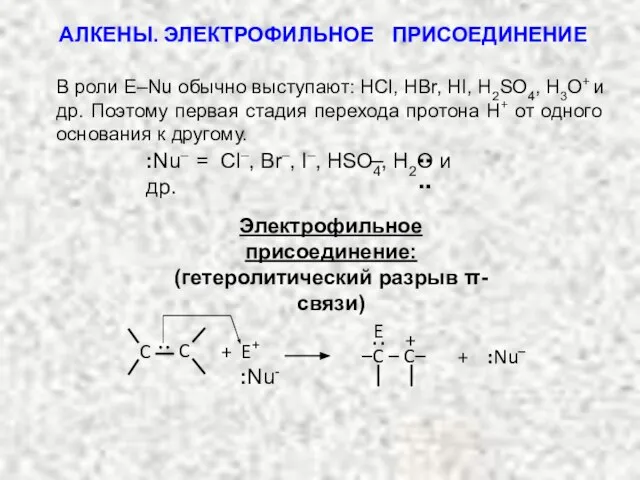
- 10. π–связь реагирует с соединениями, которые объединены электронами (т.е. с электрофилами). Поэтому типичными реакциями алкенов являются реакции
- 11. ЭЛЕКТРОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ 1-ая стадия: атака π-электроного облака электрофильным реагентом (медленная стадия): карбкатион + E–C–C– +:Nu C=C
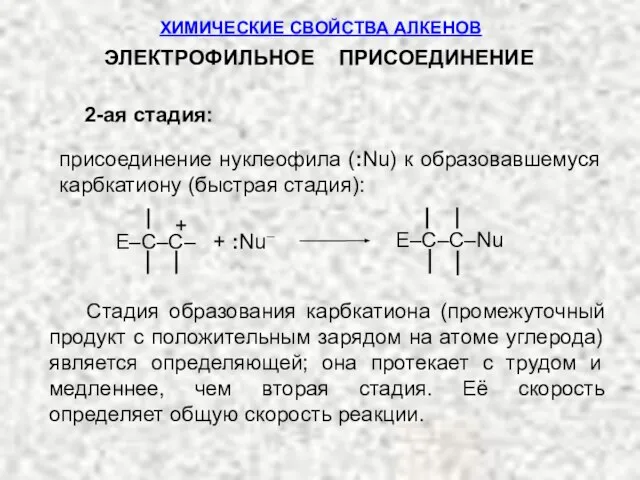
- 12. 2-ая стадия: присоединение нуклеофила (:Nu) к образовавшемуся карбкатиону (быстрая стадия): + E–C–C– + :Nu– E–C–C–Nu Стадия
- 13. :Nu– = Cl–, Br–, I–, HSO4, H2О и др. В роли E–Nu обычно выступают: HCl, HBr,
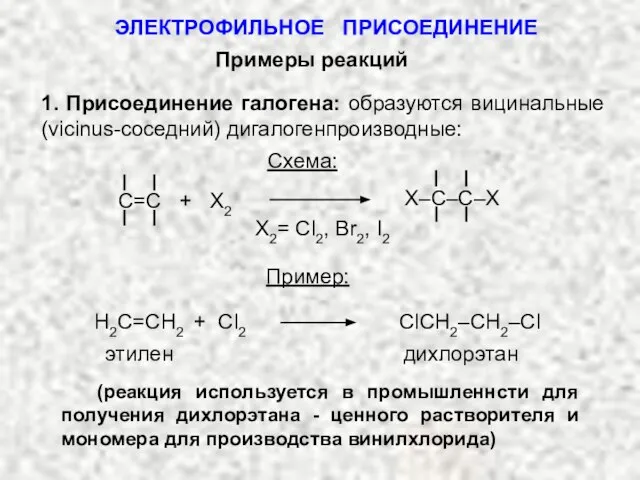
- 14. Примеры реакций 1. Присоединение галогена: образуются вицинальные (vicinus-соседний) дигалогенпроизводные: Схема: С=C + Х2 X–C–C–X X2= Cl2,
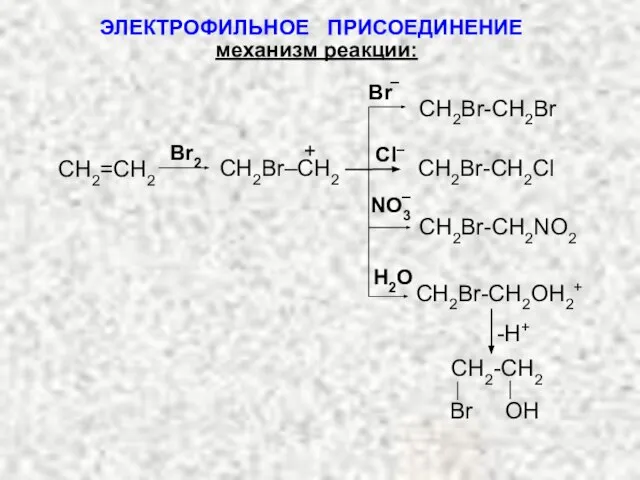
- 15. механизм реакции: На 1-ой стадии алкен поляризует молекулу галогена: На 2-ой стадии к карбкатиону может присоединяться
- 16. -H+ CH2Br-CH2OH2+ NO3 H2O CH2Br-CH2NO2 Br Cl– CH2Br-CH2Cl CH2Br-CH2Br – – ЭЛЕКТРОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ механизм реакции:
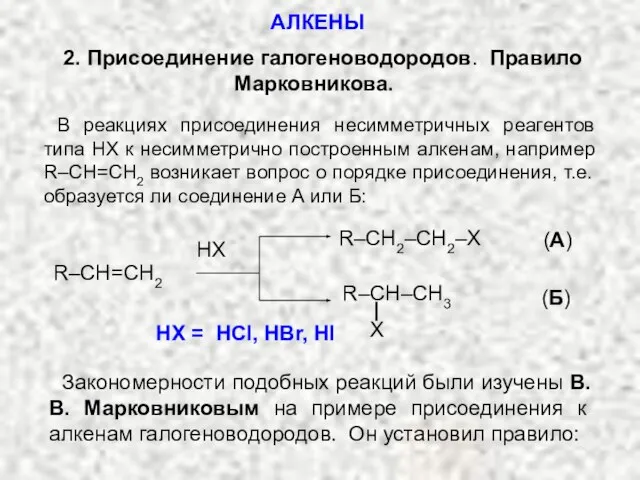
- 17. 2. Присоединение галогеноводородов. Правило Марковникова. В реакциях присоединения несимметричных реагентов типа НХ к несимметрично построенным алкенам,
- 18. «При присоединении галогено-водородов к несимметричным алкенам водород присоеди-няется к наиболее гидрогенизированному атому углерода»: CH3–CH=CH2 + HBr
- 19. В применении к нашему случаю: направление реакции будет определяться устойчивостью промежуточного карбкатиона и изменяться в последовательности:
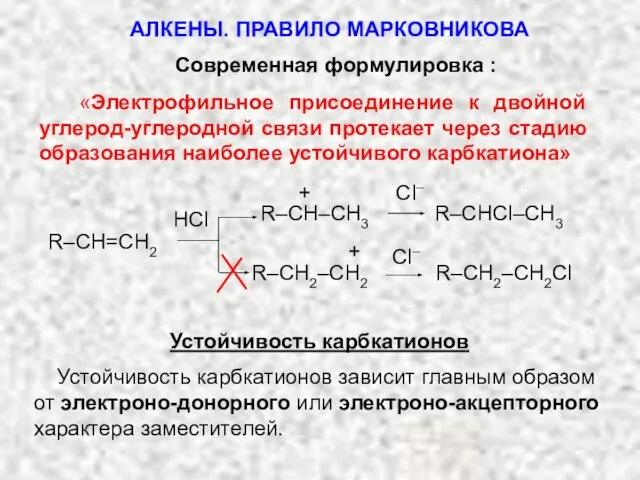
- 20. Современная формулировка : «Электрофильное присоединение к двойной углерод-углеродной связи протекает через стадию образования наиболее устойчивого карбкатиона»
- 21. Электронодонорные заместители повышают устойчивость карбкатиона, т.к. стремятся уменьшить положительный заряд на углероде (делокализуют заряд). Электроноакцепторные заместители
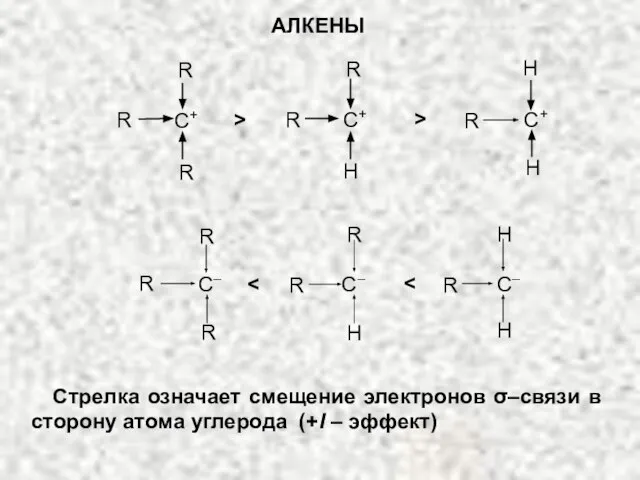
- 22. УСТОЙЧИВОСТЬ КАРБКАТИОНОВ Алкильные радикалы проявляют электронодонорный, или положительный индукционный эффект (+I-эффект), поэтому чем больше таких радикалов
- 23. R R R C+ R H R C+ H H R C+ > > R R
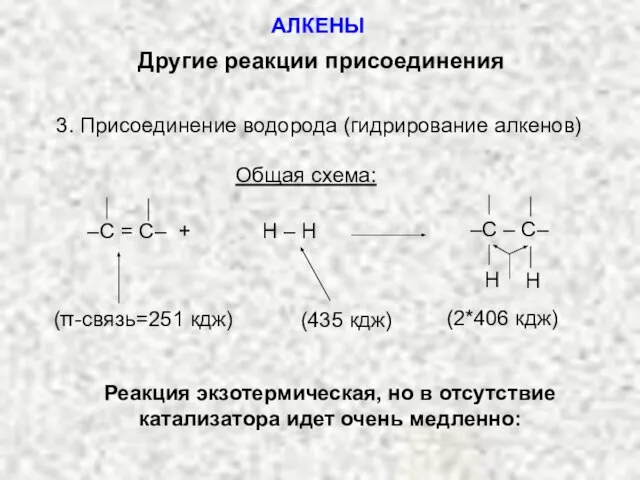
- 24. Другие реакции присоединения 3. Присоединение водорода (гидрирование алкенов) Общая схема: (π-связь=251 кдж) (435 кдж) (2*406 кдж)
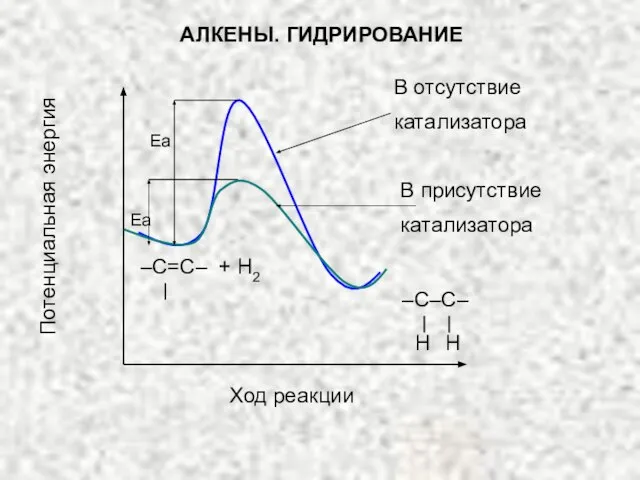
- 25. Потенциальная энергия Ход реакции –С=С– + Н2 Еа Еа –С–С– Н Н АЛКЕНЫ. ГИДРИРОВАНИЕ
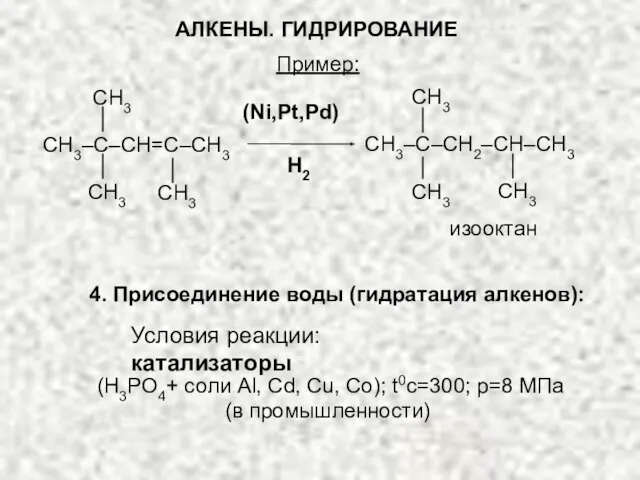
- 26. Пример: 4. Присоединение воды (гидратация алкенов): (H3PO4+ соли Al, Cd, Cu, Co); t0c=300; p=8 МПа (в
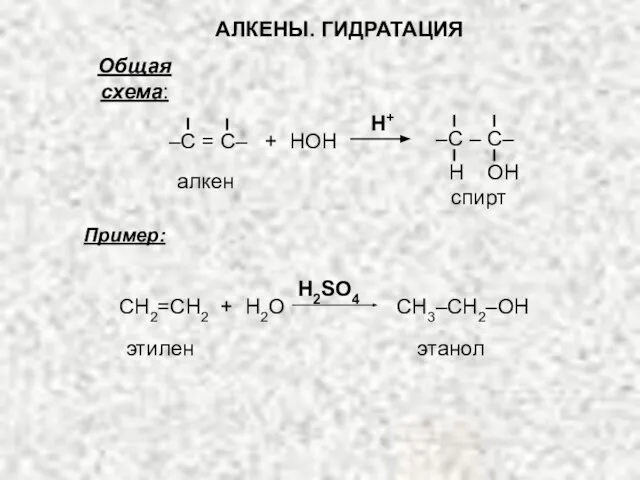
- 27. Общая схема: Пример: АЛКЕНЫ. ГИДРАТАЦИЯ
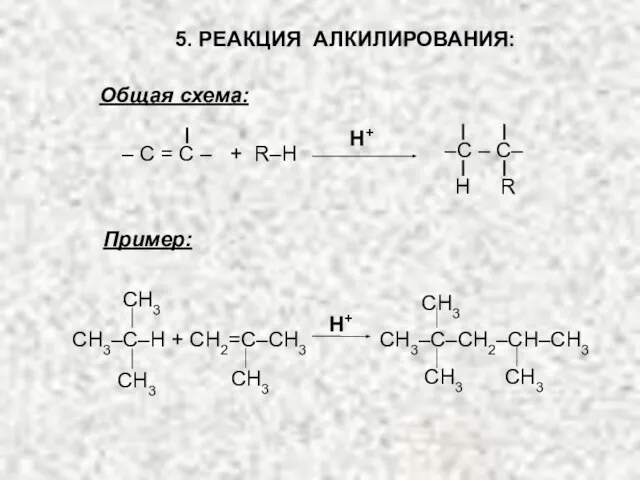
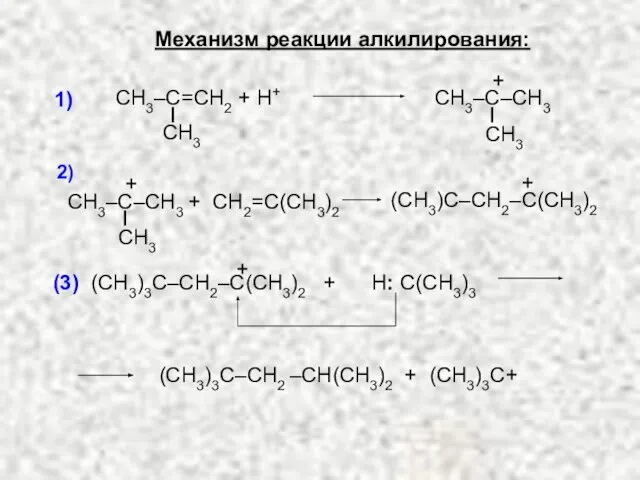
- 28. 5. РЕАКЦИЯ АЛКИЛИРОВАНИЯ: Общая схема: Пример:
- 29. Механизм реакции алкилирования: СН3–С=СН2 + Н+ СН3 1) + СН2=С(СН3)2 + (СН3)С–СН2–С(СН3)2 2) (СН3)3С–СН2 ‒СН(СН3)2 +
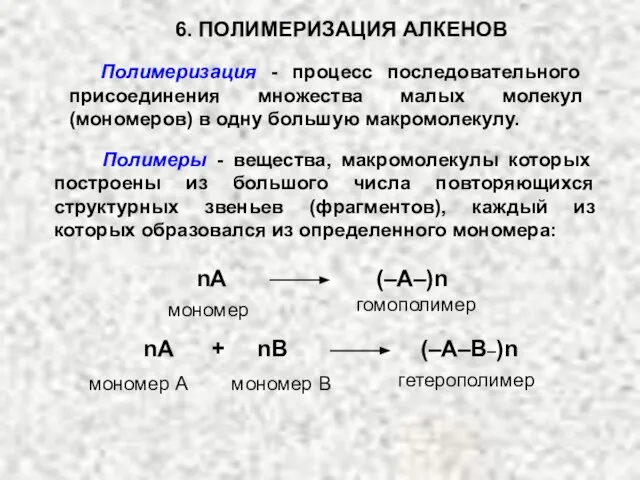
- 30. 6. ПОЛИМЕРИЗАЦИЯ АЛКЕНОВ Полимеризация - процесс последовательного присоединения множества малых молекул (мономеров) в одну большую макромолекулу.
- 31. X–Y + nA X–(A)n–Y Концевые группы Инициатор мономер Реакция полимеризации может протекать по ионному или радикальному
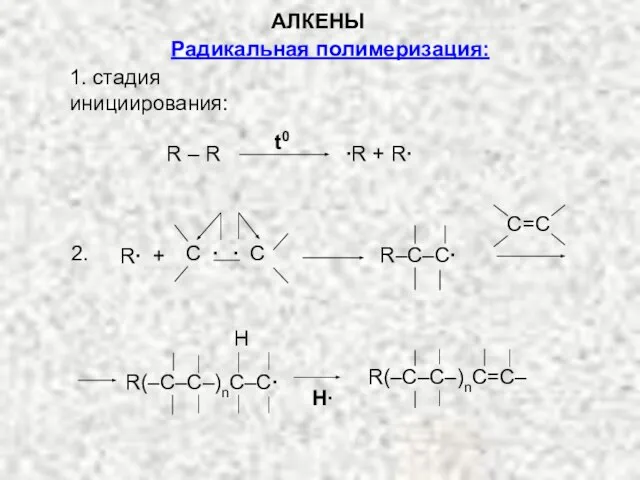
- 32. Радикальная полимеризация: 1. стадия инициирования: R – R ∙R + R∙ t0 C=C R–C–C∙ R∙ +
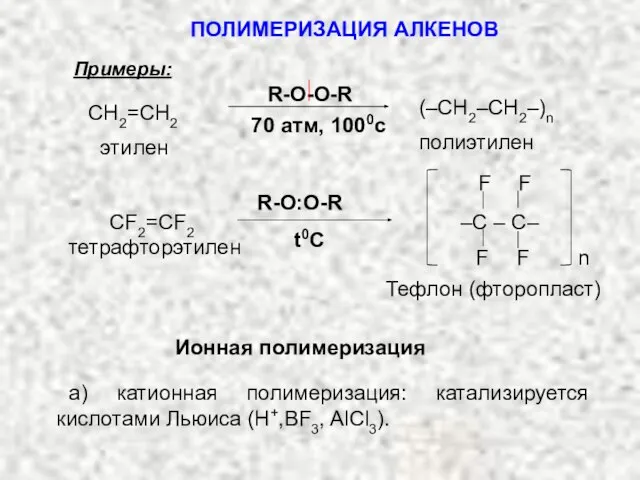
- 33. Примеры: тетрафторэтилен R-O:O-R t0C Тефлон (фторопласт) СF2=CF2 Ионная полимеризация а) катионная полимеризация: катализируется кислотами Льюиса (Н+,ВF3,
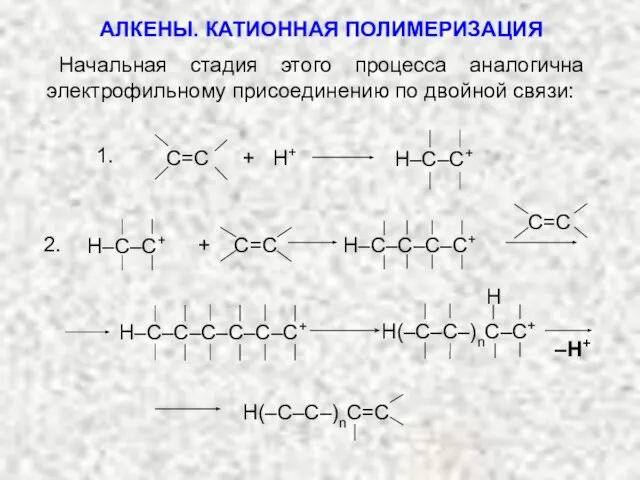
- 34. Начальная стадия этого процесса аналогична электрофильному присоединению по двойной связи: –H+ Н(–С–С–)nC–С+ H Н–С–С–С–С–С–С+ АЛКЕНЫ. КАТИОННАЯ
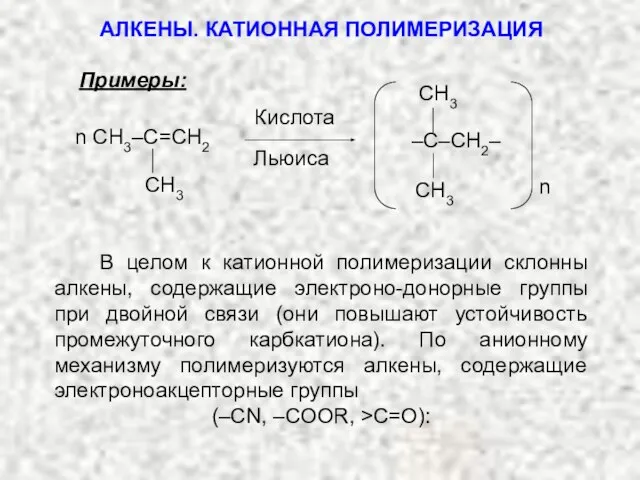
- 35. Примеры: n CH3–C=CH2 CH3 Кислота Льюиса n В целом к катионной полимеризации склонны алкены, содержащие электроно-донорные
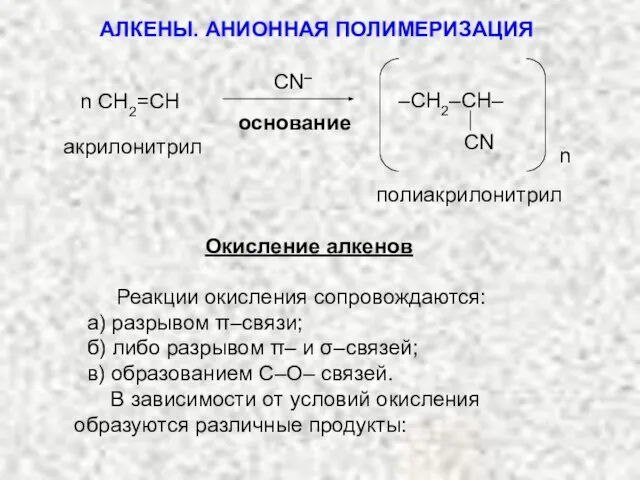
- 36. основание n акрилонитрил полиакрилонитрил n CH2=CH CN ̶ –СH2–CH– CN Окисление алкенов Реакции окисления сопровождаются: а)
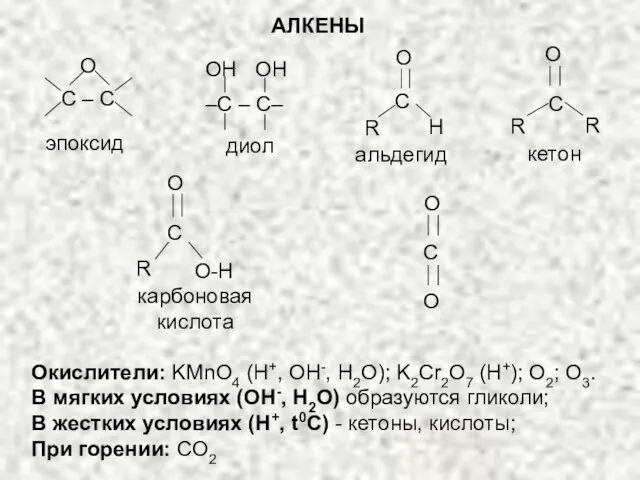
- 37. Окислители: KMnO4 (H+, OH-, H2O); K2Cr2O7 (H+); O2; O3. В мягких условиях (OH-, H2O) образуются гликоли;
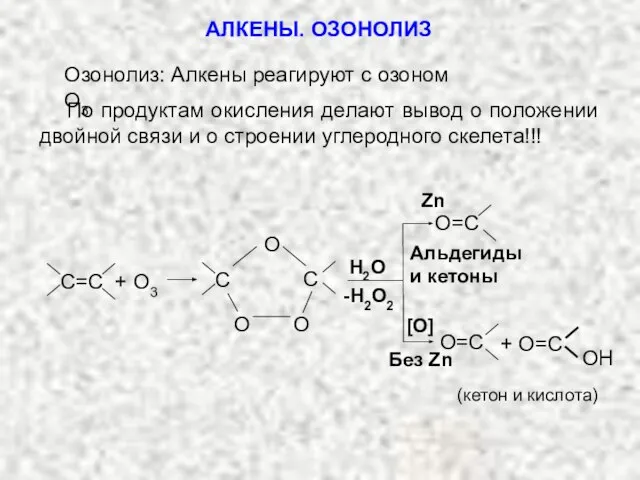
- 38. По продуктам окисления делают вывод о положении двойной связи и о строении углеродного скелета!!! Озонолиз: Алкены
- 39. ДОМАШНЕЕ ЗАДАНИЕ Реакции алкенов 1.(А.Терней, 0,323, I): какие вещества вы получите при гидратации следующих соединений в
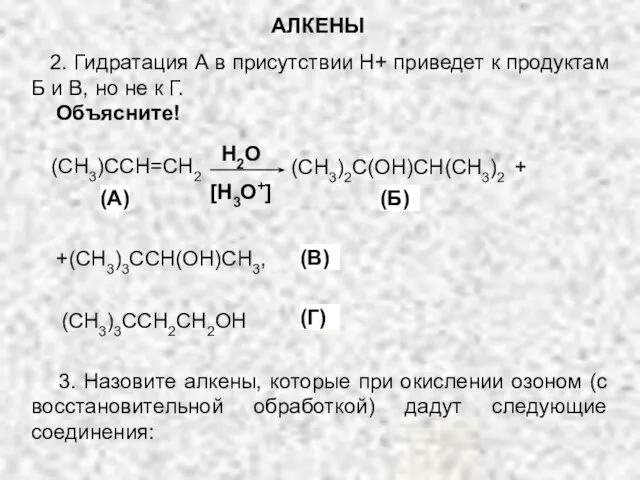
- 40. 2. Гидратация А в присутствии Н+ приведет к продуктам Б и В, но не к Г.
- 42. Скачать презентацию









 Реализация проекта. План проекта мебель-трансформер
Реализация проекта. План проекта мебель-трансформер Урок презентация на тему Храм Василия Блаженного
Урок презентация на тему Храм Василия Блаженного  EISBERG MODELL
EISBERG MODELL «Преобразование транспортно-коммуникационных пространств городов. Санкт-Петербург. Площадь Балтийского вокзала»
«Преобразование транспортно-коммуникационных пространств городов. Санкт-Петербург. Площадь Балтийского вокзала» История одного города
История одного города Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне
Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Презентация на тему Секреты долголетия
Презентация на тему Секреты долголетия Профсоюзы
Профсоюзы Налоговая реформа княгини Ольги
Налоговая реформа княгини Ольги Здоровьесберегающие образовательные технологии в педиатрии
Здоровьесберегающие образовательные технологии в педиатрии  Управление качеством образования на основе совершенствования научно-методической работы
Управление качеством образования на основе совершенствования научно-методической работы Практика стратегического анализа в российских городах
Практика стратегического анализа в российских городах МИСПИ(1)
МИСПИ(1) Анна Ахматова
Анна Ахматова Ребёнок один в машине
Ребёнок один в машине Китайские картины
Китайские картины Презентация на тему Требования к оформлению презентации
Презентация на тему Требования к оформлению презентации Требования к курсовой работе
Требования к курсовой работе Быстрая настройка рекламы в свадебной сфере!
Быстрая настройка рекламы в свадебной сфере! Калькулювання виробничой собівартості продукціи (робіт, послуг)
Калькулювання виробничой собівартості продукціи (робіт, послуг) СКОРО В ПРОДАЖЕ Артикул: 116012 Размер: 56,62 Лот 8 шт. Цвет: желтый, розовый, голубой, белый Полотно: капитон Примечания: застежка – кнопки
СКОРО В ПРОДАЖЕ Артикул: 116012 Размер: 56,62 Лот 8 шт. Цвет: желтый, розовый, голубой, белый Полотно: капитон Примечания: застежка – кнопки Street-Art et immeubles peints
Street-Art et immeubles peints Выбор ниши
Выбор ниши Презентация на тему Детство Пушкина (9 класс)
Презентация на тему Детство Пушкина (9 класс)  Полевые транзисторы. Самостоятельная работа
Полевые транзисторы. Самостоятельная работа Презентация на тему Жизнь и творчество А.Т. Твардовского
Презентация на тему Жизнь и творчество А.Т. Твардовского  Модерн в природе
Модерн в природе Закономерности эволюции
Закономерности эволюции