Содержание
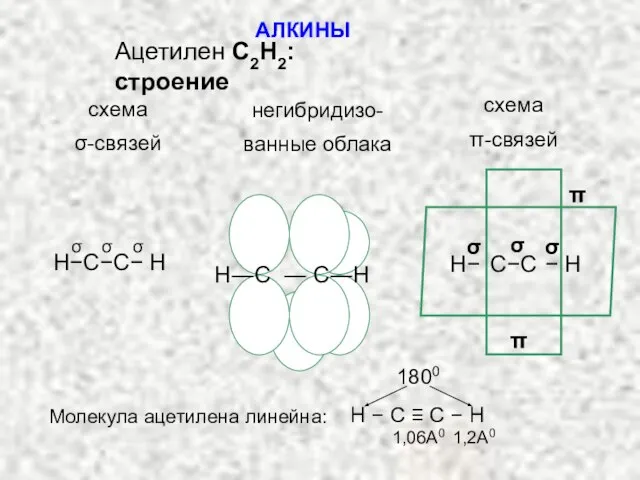
- 2. АЛКИНЫ Ацетилен С2H2: строение схема σ-связей негибридизо- ванные облака схема π-связей σ σ σ H−C−C− H
- 3. ПОЛУЧЕНИЕ АЛКИНОВ Промышленные способы получения ацетилена: 1. Из природного газа при крекинге нефти: 2CH4 C2H2 +
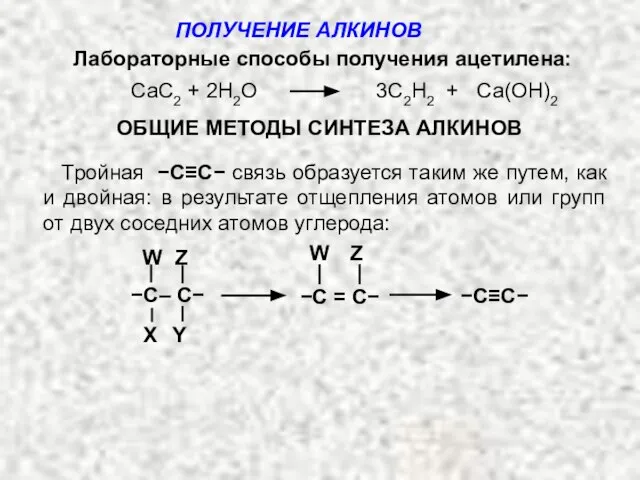
- 4. Лабораторные способы получения ацетилена: CaC2 + 2H2O 3C2H2 + Са(ОH)2 ОБЩИЕ МЕТОДЫ СИНТЕЗА АЛКИНОВ Тройная −С≡С−
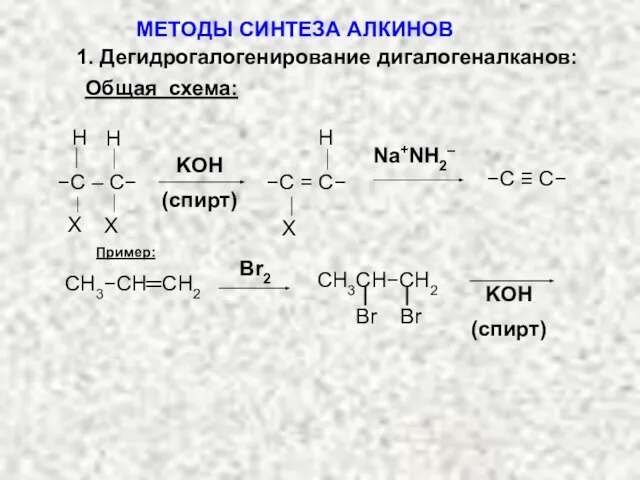
- 5. 1. Дегидрогалогенирование дигалогеналканов: Общая схема: Пример: Br2 KOH (спирт) Br Br CH3CH−CH2 СH3−CH═CH2 МЕТОДЫ СИНТЕЗА АЛКИНОВ
- 6. NaNH2 пропин СH3CH═CH Br CH3−C≡CH Na+NH2- или Na −C≡CR + Na+X– RX −C≡C–:Na+ −С≡СH (R-первичный алкил;
- 7. Пример: CH≡C−Na + CH3I CH≡C−CH3 + NaI ФИЗИЧЕСКИЕ СВОЙСТВА АЛКИНОВ Напоминают алкены и алканы: низшие алкины
- 8. Для алкинов характерны две группы реакций: 1. Реакции электрофильного присоединения. 2. Реакции, обусловленные кислотностью водород- ного
- 9. 1. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ Алкины, как и алкены, вступают в реакции электрофильного присоединения, т.к. у них
- 10. Механизм присоединения такой же как для алкенов самый, но каждая тройная связь может присоединить две молекулы
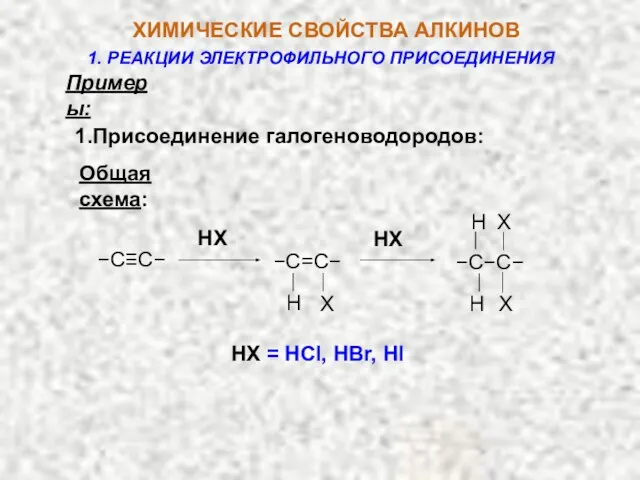
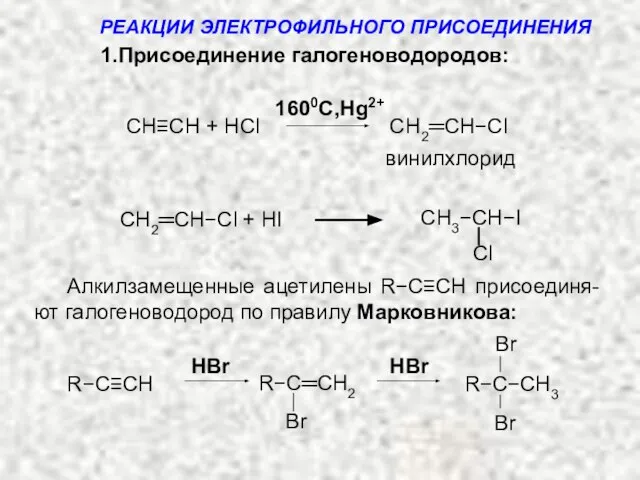
- 11. Примеры: 1.Присоединение галогеноводородов: Общая cхема: HX = HCl, HBr, HI HX HX −C≡C− X Н −C=C−
- 12. CH≡CH + HCl CH2═CH−Cl винилхлорид CH3−CH−I СH2═CH−Cl + HI Алкилзамещенные ацетилены R−С≡СH присоединя-ют галогеноводород по правилу
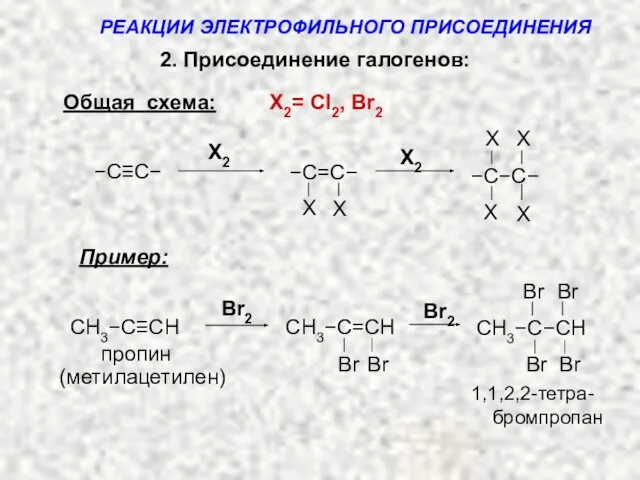
- 13. 2. Присоединение галогенов: Общая схема: X2= Cl2, Br2 Пример: пропин 1,1,2,2-тетра- Br Br Br CH3−C−CH Br
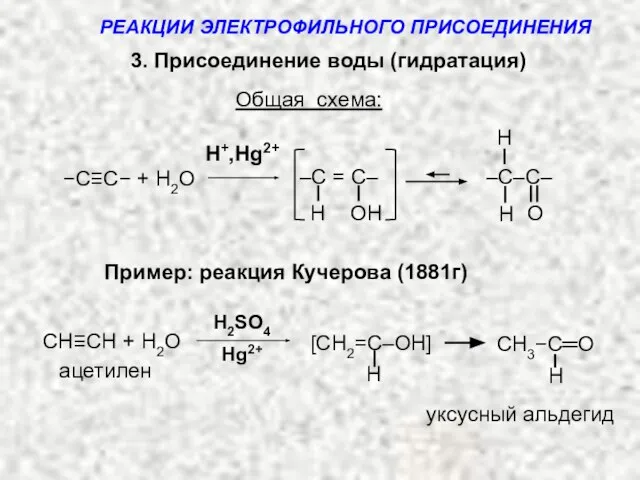
- 14. 3. Присоединение воды (гидратация) Общая схема: H+,Hg2+ H ОH –C = C– −C≡C− + H2O H
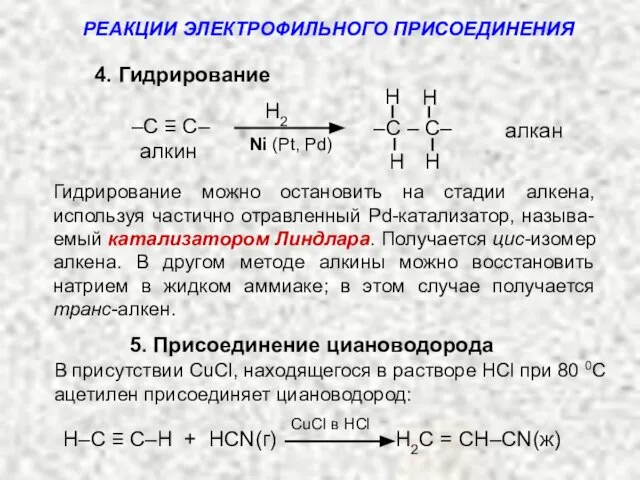
- 15. 4. Гидрирование алкан алкин H H H H –C – C– –C ≡ C– РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО
- 16. 2. РЕАКЦИИ ЗАМЕЩЕНИЯ. КИСЛОТНОСТЬ АЛКИНОВ Алкины с концевой тройной связью реагируют с некоторыми основаниями, при этом
- 17. 2. КИСЛОТНОСТЬ АЛКИНОВ. Согласно Бренстеду-Лоури, кислоты представляют собой вещества, отдающие протон, а основания – вещества, присоединяющие
- 18. Кислотность вещества зависит от характера атома, с которым связан водород: кислотность вещества тем больше, чем выше
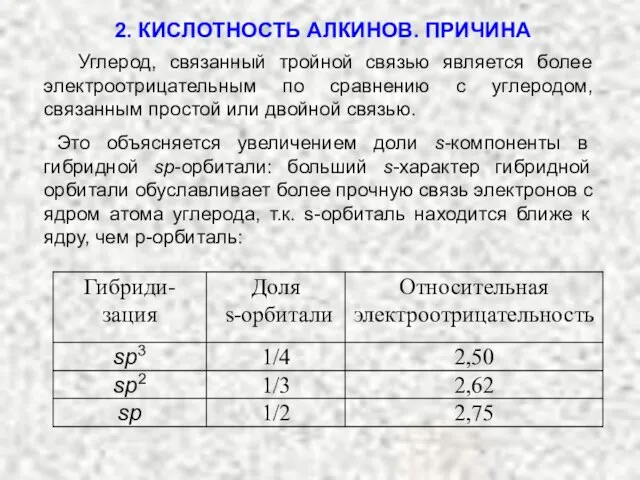
- 19. Углерод, связанный тройной связью является более электроотрицательным по сравнению с углеродом, связанным простой или двойной связью.
- 20. орбитали увеличение полярности связи C−H увеличение кислотных свойств водорода Таким образом водород, связанный с атомом углерода
- 21. Гомолитический разрыв связи с образованием радикалов затруднен, а гетеролитический протекает легче: H−C≡C−H H−C≡C∙ + H∙ H−C≡C−H
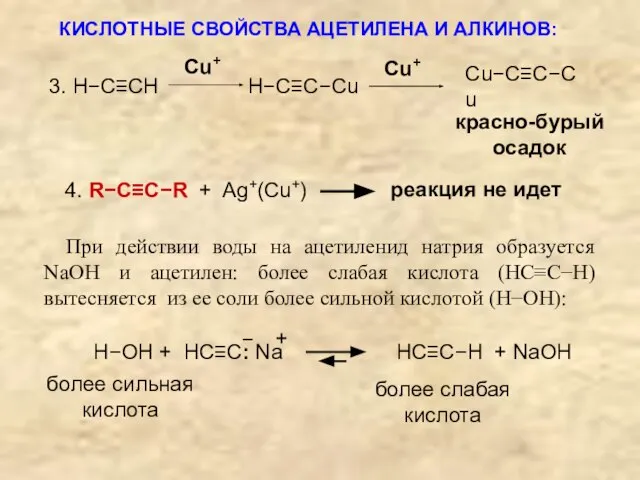
- 22. КИСЛОТНЫЕ СВОЙСТВА АЦЕТИЛЕНА И АЛКИНОВ: (R−C≡CH) проявляются, например, в их реакциях с ионами Na+, Ag+, Cu+
- 23. 4. R−C≡C−R + Ag+(Cu+) реакция не идет При действии воды на ацетиленид натрия образуется NaOH и
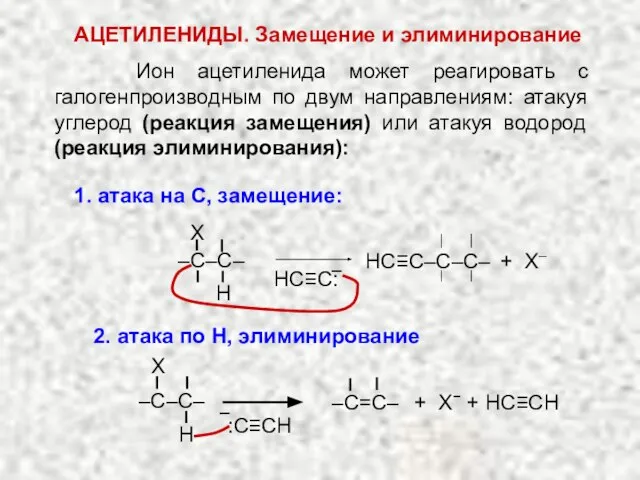
- 24. АЦЕТИЛЕНИДЫ. Нуклеофильное замещение Образование нерастворимых ацетиленидов тяжелых металлов (Ag, Cu) является качественной реакцией на атом водорода
- 25. Ион ацетиленида может реагировать с галогенпроизводным по двум направлениям: атакуя углерод (реакция замещения) или атакуя водород
- 26. АЛКИНЫ Элиминирование возрастает RX= первичный, вторичный, третичный Замещение возрастает КОНКУРЕНЦИЯ ЭЛИМИНИРОВАНИЯ И ЗАМЕЩЕНИЯ
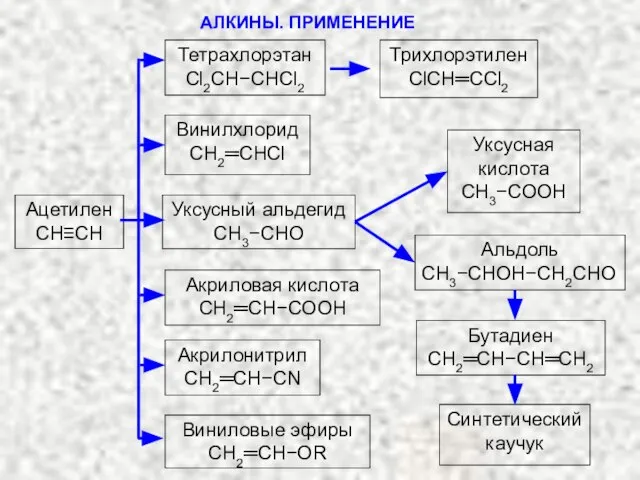
- 27. АЛКИНЫ. ПРИМЕНЕНИЕ Ацетилен СH≡CH Тетрахлорэтан Cl2CH−CHCl2 Трихлорэтилен ClCH═CCl2 Винилхлорид СH2═CHCl Уксусный альдегид CH3−CHO Уксусная кислота СH3−COOH
- 29. Скачать презентацию














 Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика
Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика My England
My England Проект переработки творожной сыворотки в ООО Молоко п. Торбеево
Проект переработки творожной сыворотки в ООО Молоко п. Торбеево Ing form or infinitive
Ing form or infinitive Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015
Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015 Гласные и согласные
Гласные и согласные Репродуктивные органы размножения у растений
Репродуктивные органы размножения у растений OneTouch Marketing Activity
OneTouch Marketing Activity Ангел на шпиле Петропавловского собора
Ангел на шпиле Петропавловского собора Презентация на тему Правила поведения при пожаре
Презентация на тему Правила поведения при пожаре  Фен. Косметический девичник
Фен. Косметический девичник Валютный рынок FOREX
Валютный рынок FOREX ДЕСЕРТЫ
ДЕСЕРТЫ фонтан на книжной полке
фонтан на книжной полке Тоннель
Тоннель Электромагнитные явления
Электромагнитные явления Проект«Возможно ли в наше время сохранение единого русского литературного языка?»
Проект«Возможно ли в наше время сохранение единого русского литературного языка?» Как РА найти веб-студию и не потерять клиента?
Как РА найти веб-студию и не потерять клиента? Генетика человека 11 класс
Генетика человека 11 класс Урок № 3 Сценография – особый вид художественного творчества
Урок № 3 Сценография – особый вид художественного творчества Как делать контрольную работу
Как делать контрольную работу Чем опасна толпа
Чем опасна толпа Брошюра для родителей. Наше творчество
Брошюра для родителей. Наше творчество Понятие коммуникационного процесса. Модель коммуникации лассуэла
Понятие коммуникационного процесса. Модель коммуникации лассуэла Химическое многоборье
Химическое многоборье 菲奥娜和史莱克
菲奥娜和史莱克 Россия и страны бывшего СССР: если интегрироваться, то с кем?
Россия и страны бывшего СССР: если интегрироваться, то с кем? «Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»
«Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»