Содержание
- 2. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ 1. Классификация органических реакций по изменению числа частиц в ходе реакции 1. 1.Реакции
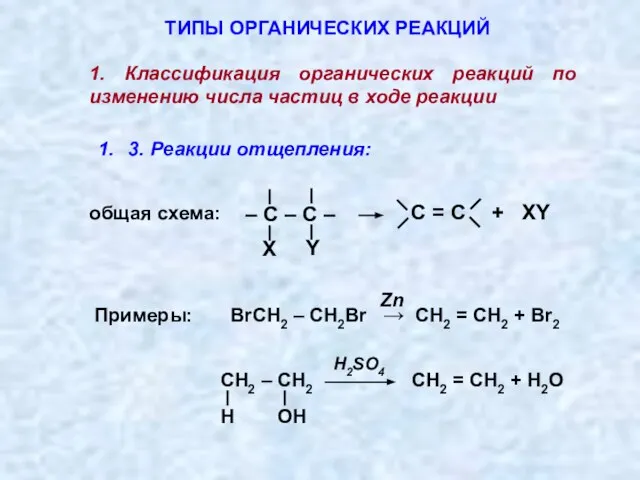
- 3. 3. Реакции отщепления: ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ 1. Классификация органических реакций по изменению числа частиц в ходе
- 4. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ Реакции замещения характерны для всех классов органических соединений. Замещаться могут атомы водорода или
- 5. ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ 2. 2. Гетеролитическое (ионное) расщепление: 2. Классификация реакций по их механизму: В этом
- 6. Свободный радикал – атом или группа, имеющие нечетный (неспаренный) электрон. Радикалы – электрически нейтральные частицы. Ионы
- 7. РАДИКАЛЫ И ИОНЫ \ \ 1. – С : X – С+ + : X– (X
- 8. ТЕОРИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Чтобы между двумя частицами произошла реакция необходимы определенные условия: 1. Частица должны столкнуться;
- 9. исходные переходное конечные вещества состояние вещества Химическая реакция представляет собой непрерывный процесс, заключающийся в постепенном переходе
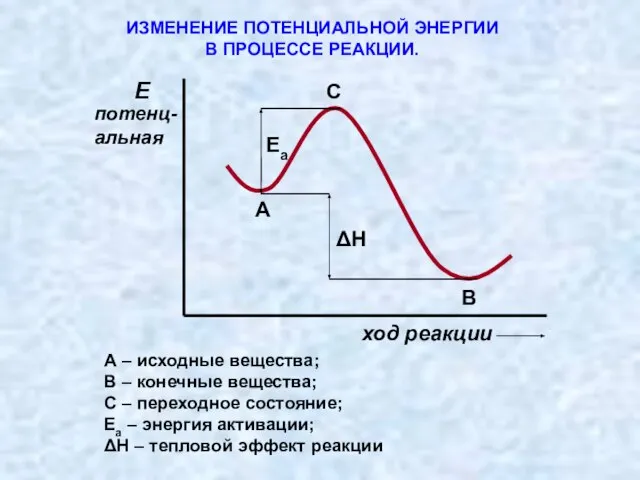
- 10. ИЗМЕНЕНИЕ ПОТЕНЦИАЛЬНОЙ ЭНЕРГИИ В ПРОЦЕССЕ РЕАКЦИИ. А – исходные вещества; В – конечные вещества; С –
- 11. ИЗМЕНЕНИЕ ПОТЕНЦИАЛЬНОЙ ЭНЕРГИИ В ПРОЦЕССЕ РЕАКЦИИ. Величина энергии активации определяет возможность и скорость химической реакции: чем
- 12. При оценке возможного направления реакции необходимо знать структуру переходного состояния. Никакими физическими методами это сделать принципиально
- 13. «При атаке реагентом с высокой реакционной способностью (значение Еа мало) переходное состояние достигается быстро, исходные вещества
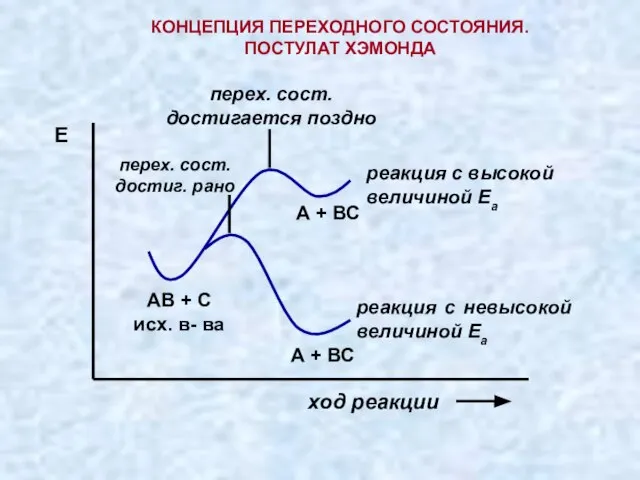
- 14. ПОСТУЛАТ ХЭММОНДА Для лучшего понимания этого утверждения обратимся к диаграмме изменения потенциальной энергии в ходе реакции:
- 15. КОНЦЕПЦИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ. ПОСТУЛАТ ХЭМОНДА ход реакции перех. сост. достигается поздно перех. сост. достиг. рано А
- 16. Из концепции переходного состояния следует: Если реакция может пойти в нескольких направлениях, то преимущественным будет путь,
- 17. КОНЦЕПЦИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ. ПОСТУЛАТ ХЭМОНДА Как общее правило: реакция идет тем легче, чем легче образуются характеризующие
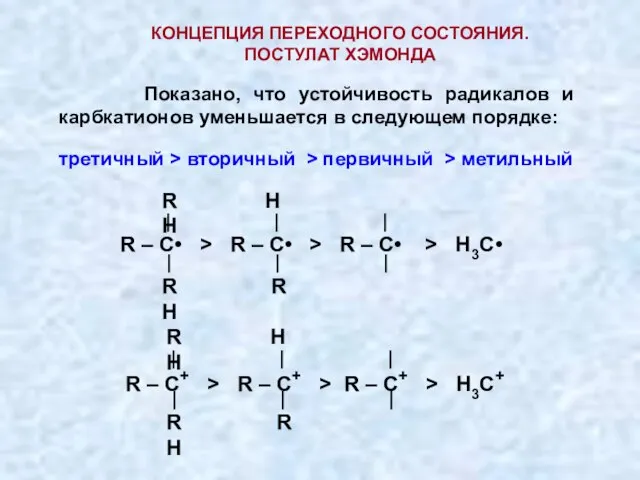
- 18. КОНЦЕПЦИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ. ПОСТУЛАТ ХЭМОНДА Показано, что устойчивость радикалов и карбкатионов уменьшается в следующем порядке: третичный
- 19. В рассредоточении электрического заряда (электронов) большую роль играют полярные электронные эффекты заместителей: УСТОЙЧИВОСТЬ РАДИКАЛОВ И ИОНОВ
- 20. Индукционный эффект – эффект, обусловленный стремлением атома или группы атомов подавать или оттягивать электроны. Различают положительный
- 21. Индукционный эффект – эффект, который атом или группа атомов оказывает на электронную плотность у соседнего центра
- 22. Если заместитель (атом или группа атомов) подает электронную плотность сигма-связи на атом углерода, то такой заместитель
- 23. ИНДУКЦИОННЫЙ ЭФФЕКТ (I – ЭФФЕКТ) + I – эффект: – I - эффект: Знак и величину
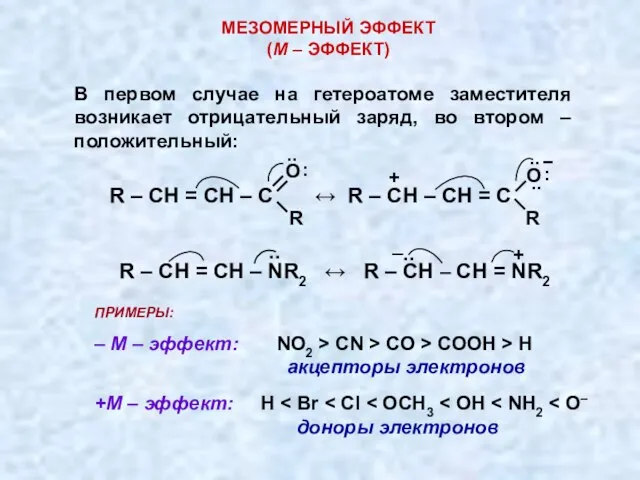
- 24. МЕЗОМЕРНЫЙ ЭФФЕКТ (М – ЭФФЕКТ) Мезомерный эффект означает смещение π-электронов, а также неподеленных электрон-ных пар атомов
- 25. В первом случае на гетероатоме заместителя возникает отрицательный заряд, во втором – положительный: МЕЗОМЕРНЫЙ ЭФФЕКТ (М
- 26. 1) чем выше заряд заместителя 2) чем выше ЭО гетероатома (- I– эффект) а) NR2 3)
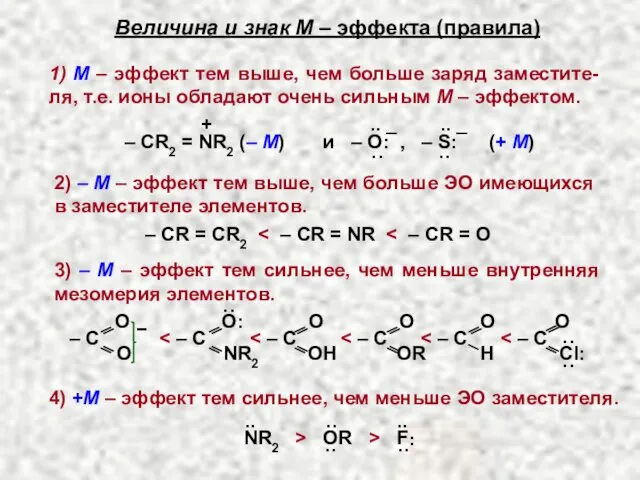
- 27. Величина и знак М – эффекта (правила) 1) М – эффект тем выше, чем больше заряд
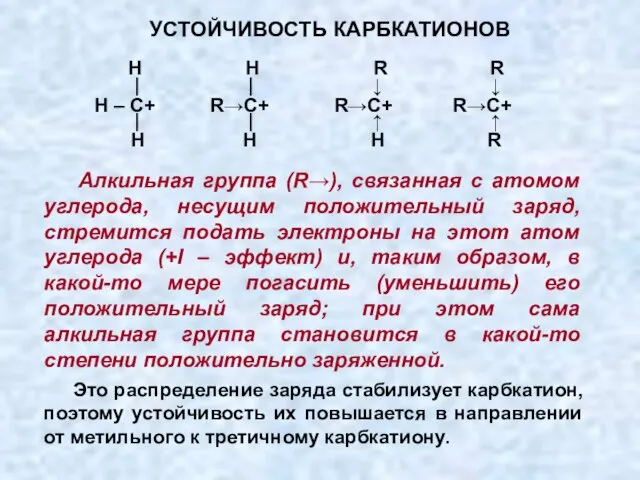
- 28. Алкильная группа (R→), связанная с атомом углерода, несущим положительный заряд, стремится подать электроны на этот атом
- 29. УСТОЙЧИВОСТЬ КАРБКАТИОНОВ ДРУГОЙ ПРИМЕР:
- 30. 1. Свободнорадикальные реагенты (радикалы). 2. Электрофильные реагенты (электрофилы). 3. Нуклеофильные реагенты (нуклеофилы). Радикалы – атомы или
- 31. Электрофилы – частицы, обладающие повышенным сродством к электрону или отрицательно заряженным центрам. Они делятся на сильные
- 32. Нуклеофилы – частицы, имеющие центры с повышенной электронной плотностью. Сильные нуклеофилы: анионы с высоким сродством к
- 33. ПРИМЕЧАНИЕ: Электрофил – акцептор электронной пары (кислота Льюиса) Нуклеофил – донор электронной пары (основание Льюиса) Все
- 34. ОСНОВНОСТЬ – сродство к протону. НУКЛЕОФИЛЬНОСТЬ – способность образовывать связи с электрофильным атомом углерода. Термины «нуклеофил»
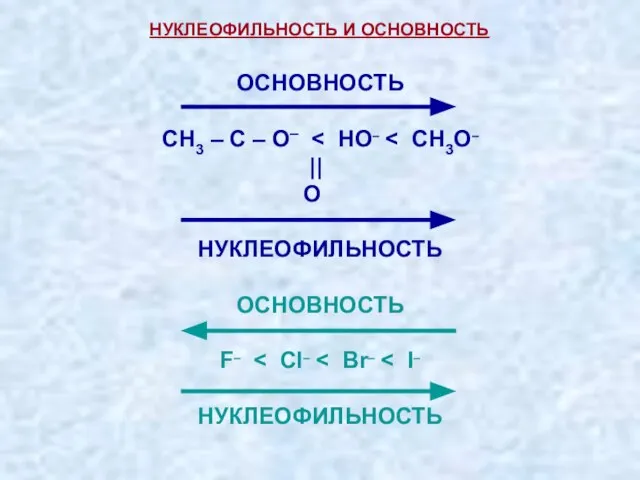
- 35. НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ ОСНОВНОСТЬ – сродство к протону. НУКЛЕОФИЛЬНОСТЬ – способность образовывать связи с электрофильным атомом
- 36. Нуклеофильность частиц зависит от электронной плотности на атакующем атоме (основности) и от поляризуемости электронов. нуклеофильность =
- 37. НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ ОСНОВНОСТЬ СH3 – С – O– || O НУКЛЕОФИЛЬНОСТЬ ОСНОВНОСТЬ F– НУКЛЕОФИЛЬНОСТЬ
- 38. End ПОСТУЛАТ ХЭММОНДА ЗЛЕКТРОФИЛЫ И НУКЛЕОФИЛЫ (+,-)I-ЭФФЕКТ; (+,-)М-ЭФФЕКТ НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ
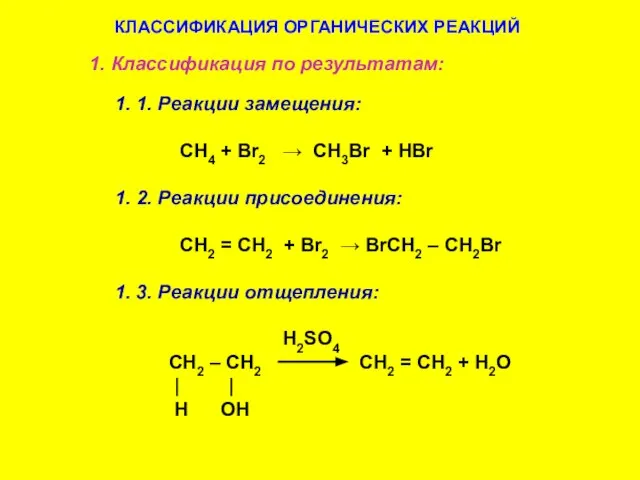
- 39. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ 1. Классификация по результатам: 1. 1. Реакции замещения: CH4 + Br2 → CH3Br
- 41. Скачать презентацию





























 Технологическое предпринимательство для школьников: от изобретения к бизнесу! Занятие 2
Технологическое предпринимательство для школьников: от изобретения к бизнесу! Занятие 2 Романская архитектура
Романская архитектура Выборы Лидера совета старшеклассников
Выборы Лидера совета старшеклассников Роботы в древней греции
Роботы в древней греции Функция
Функция Поисковое продвижение: как увеличить его эффективность?
Поисковое продвижение: как увеличить его эффективность? Рекламные решения
Рекламные решения Мегалитическая архитектура 8 класс
Мегалитическая архитектура 8 класс Планета дорог
Планета дорог Забота о ближнем - призвание христианина
Забота о ближнем - призвание христианина МОДЕЛИ ПЕДАГОГИЧЕСКОГО ОБЩЕНИЯ
МОДЕЛИ ПЕДАГОГИЧЕСКОГО ОБЩЕНИЯ Презентация на тему Правила поведения при пожаре
Презентация на тему Правила поведения при пожаре  Викторина по произведению А.С. Пушкина "Капитанская дочка"
Викторина по произведению А.С. Пушкина "Капитанская дочка" Конструирование и моделирование одежды
Конструирование и моделирование одежды Медиабезопасность
Медиабезопасность Агатэ Элерс, отдел Международного сотрудничества Услуги и опыт Немецкого Энергетического Агентства в реализации СО- и МЧР-проект
Агатэ Элерс, отдел Международного сотрудничества Услуги и опыт Немецкого Энергетического Агентства в реализации СО- и МЧР-проект ВСЕМ! ВСЕМ! ВСЕМ! 7 ФЕВРАЛЯ, В 17 ЧАСОВ ГИМНАЗИЯ № 3 ЖДЁТ СВОИХ ВЫПУСКНИКОВ
ВСЕМ! ВСЕМ! ВСЕМ! 7 ФЕВРАЛЯ, В 17 ЧАСОВ ГИМНАЗИЯ № 3 ЖДЁТ СВОИХ ВЫПУСКНИКОВ  Что нас окружает ?
Что нас окружает ? НИД кафедры ЭиУ в 2020/21 уч. году Проблемы, задачи, пути развития
НИД кафедры ЭиУ в 2020/21 уч. году Проблемы, задачи, пути развития Британские художники
Британские художники Год театра в России. Научно-практическая конференция
Год театра в России. Научно-практическая конференция Презентация3
Презентация3 Винтовые лестницы
Винтовые лестницы Экспорт нефти и нормативно-правовое регулирование
Экспорт нефти и нормативно-правовое регулирование Александрова Айталина Ивановна
Александрова Айталина Ивановна Готовность первоклассника к школе
Готовность первоклассника к школе Отклонение в поведении ребенка как социально-педагогическая проблема
Отклонение в поведении ребенка как социально-педагогическая проблема Презентация на тему Миграции населения России (8 класс)
Презентация на тему Миграции населения России (8 класс)