Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1.
- 6. Горение серы в кислороде: Классификация химических реакций
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2.
- 8. Получение кислорода из перманганата калия: Классификация химических реакций
- 9. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3.
- 10. Взаимодействие натрия с водой: Классификация химических реакций
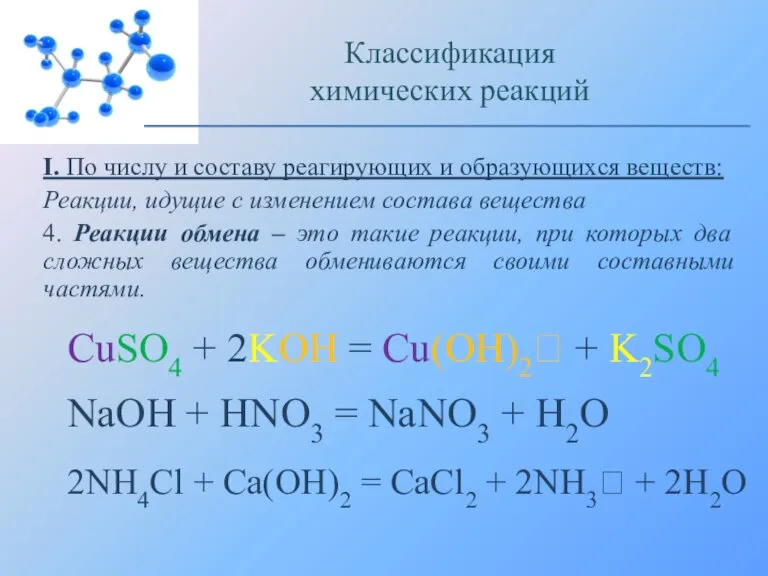
- 11. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4.
- 12. Получение аммиака из нашатыря Классификация химических реакций
- 13. II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней
- 14. Взаимодействие железа с медным купоросом: Классификация химических реакций
- 15. III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций
- 16. III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций
- 17. Разложение пероксида водорода: Классификация химических реакций
- 18. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических
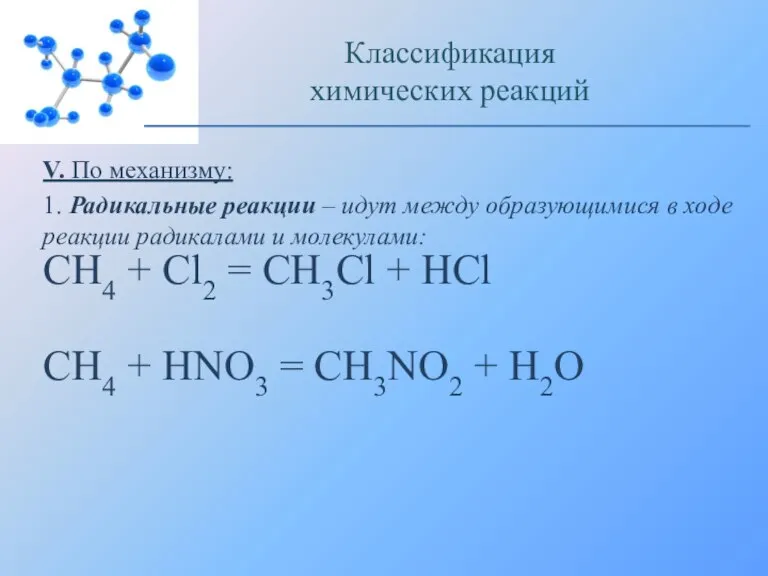
- 19. V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
- 20. V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции
- 21. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P +
- 22. Горение фосфора в кислороде: Классификация химических реакций
- 23. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 +
- 24. Разложение оксида ртути: Классификация химических реакций
- 25. VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. Радиационные реакции инициируются излучениями большой
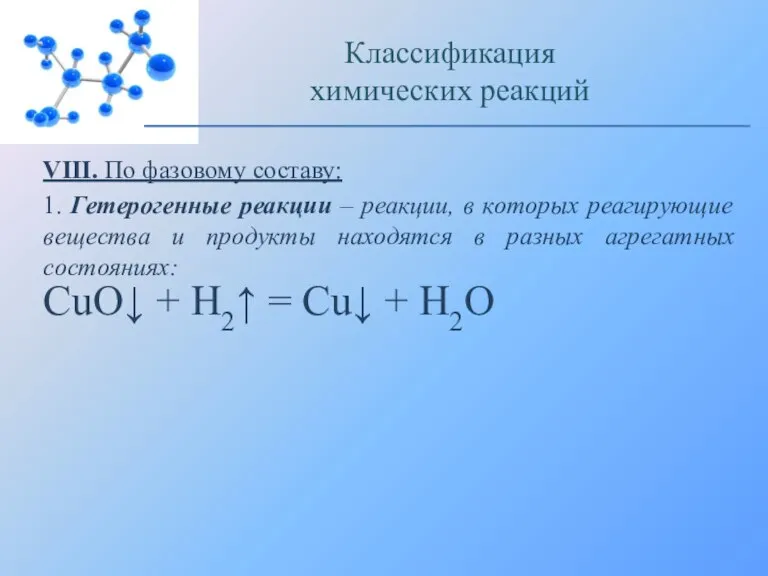
- 26. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся
- 27. Восстановление оксида меди (II) водородом: Классификация химических реакций
- 29. Скачать презентацию























 Степаненко Наталья Александровна
Степаненко Наталья Александровна Танцующий человечек из фигур
Танцующий человечек из фигур ГЕОГРАФИЯ
ГЕОГРАФИЯ Аник Автоматизация. Эффективная работа
Аник Автоматизация. Эффективная работа Переведи в см
Переведи в см ООО «НПП «АрхиМед»
ООО «НПП «АрхиМед» Сочинение по картине Ивана Ивановича Шишкина Корабельная роща
Сочинение по картине Ивана Ивановича Шишкина Корабельная роща ПОНЯТИЕ, ПРИЗНАКИ И СУЩНОСТЬ ГОСУДАРСТВА
ПОНЯТИЕ, ПРИЗНАКИ И СУЩНОСТЬ ГОСУДАРСТВА Фёдорова Наталья Петровна
Фёдорова Наталья Петровна Иконки и условные обозначения для оформления презентаций
Иконки и условные обозначения для оформления презентаций Урок-лекция: Аппаратное обеспечение КС
Урок-лекция: Аппаратное обеспечение КС Электропроводность твердых тел
Электропроводность твердых тел Решите тест
Решите тест 30 ноября.Классная работа.
30 ноября.Классная работа. Додекаэдр
Додекаэдр Презентация _Пластилинография_ (старший дошкольный возраст)
Презентация _Пластилинография_ (старший дошкольный возраст) Пейзаж в живописи
Пейзаж в живописи Презентация на тему Биологическое действие радиации
Презентация на тему Биологическое действие радиации  Стресс-тест. Форма представления. Структура доклада. Примеры
Стресс-тест. Форма представления. Структура доклада. Примеры Драматургія
Драматургія GlobalEnglishОАО «АрселорМиттал Кривой Рог»
GlobalEnglishОАО «АрселорМиттал Кривой Рог» Праздники весны народов мира
Праздники весны народов мира Пьеса Грибоедова «Горе от ума» в русской критике
Пьеса Грибоедова «Горе от ума» в русской критике Презентация на тему Грибы съедобные и несъедобные. Правила сбора грибов
Презентация на тему Грибы съедобные и несъедобные. Правила сбора грибов  Тема урока: Максимизация полезности. Бюджетное ограничение.
Тема урока: Максимизация полезности. Бюджетное ограничение. Что такое фашизм и нацизм
Что такое фашизм и нацизм Искусство оригами
Искусство оригами Скребицкий "Медвежонок" 4 класс
Скребицкий "Медвежонок" 4 класс