Слайд 2Оксиды
Образованы двумя химическими элементами
Один из элементов кислород, имеющий степень окисления

-2
Примеры: MgO, H2O
Слайд 3Оксидами являются оба вещества в паре
1)MgO и H2O2
2)Na 2O2 и BaO
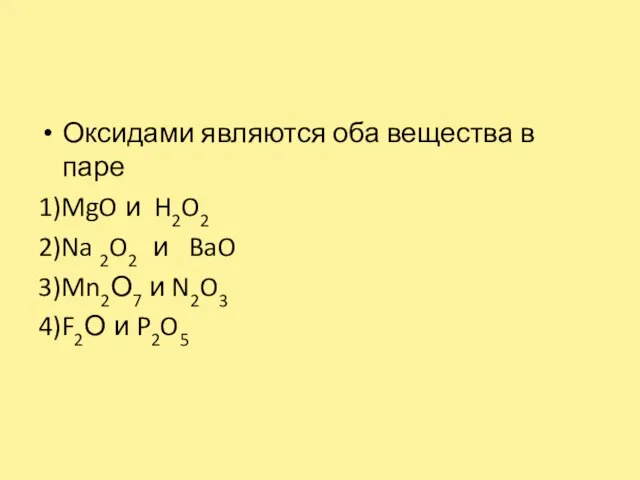
3)Mn2О7 и N2O3
4)F2О и P2O5
Слайд 4Классификация оксидов
Несолеобразующие (безразличные)
NO
CO
N2O
Солеобразующие
Основные
Кислотные
Амфотерные

Слайд 5Основные оксиды
Оксиды металлов, в которых металл имеет степень окисления +1 или +2

как правило
Основным оксидам соответствуют основания (основные гидроксиды):
Na2O – NaOH
MgO – Mg(OH)2
Слайд 6Свойства основных оксидов
Реагируют с кислотами:
MgO + H2SO4 = MgSO4 +

H2O
Некоторые реагируют с водой (оксиды щелочных и щелочно-земельных металлов):
Na2O + H2O = 2NaOH
Реагируют с кислотными оксидами:
CaO + CO2 = CaCO3
Слайд 7Кислотные оксиды
Оксиды неметаллов и металлов, в которых элемент имеет степень окисления

+4 и выше как правило
Кислотным оксидам соответствуют кислоты (кислотные гидроксиды):
CO2 – H2CO3 Mn2O7 – HMnO4
SO3 – H2SO4 CrO3 – H2CrO4, H2Cr2O7
Слайд 8Свойства кислотных оксидов
Реагируют со щелочами (растворимыми в воде основаниями):
CO2 + 2NaOH

= Na2CO3 + H2O
Большинство реагирует с водой:
SO3 + H2O = H2SO4
Реагируют с основными оксидами:
P2O5 + 3CaO = Ca3(PO4)2
Слайд 9Амфотерные оксиды
Оксиды металлов, в которых металл проявляет степень окисления +3 или

+4 как правило
Амфотерным оксидам соответствуют амфотерные гидроксиды:
Al2O3 – Al(OH)3 ZnO – Zn(OH)2
Cr2O3 – Cr(OH)3 BeO – Be(OH)2
MnO2 – Mn(OH)4
Слайд 10Свойства амфотерных оксидов
Амфотерность – двойственность свойств
Реагируют с кислотами, проявляя свойства основных

оксидов:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Реагируют со щелочами, проявляя свойства кислотных оксидов:
Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4]
Al2O3 + 2NaOH = 2NaAlO2 + H2O (при сплавлении)
Слайд 11С водой реагируют оксиды:
1)BaO и SiO2
2)СuO и SO3
3)BaO и SO3
4)FeO и

СО2
Слайд 12Оксид серы (IV) взаимодействует с каждым из двух веществ:
1)H2O и KCl
2)Ba(OH)2 и

CaO
3)CaCO3 и ZnSO3
4)Ca(OH)2 и N2
Слайд 13С соляной кислотой реагируют каждый из двух оксидов
1)K2O и SO3
2)Al2O3 и CaO

3)CO2 и ZnO
4)CrO3 и Na2O
Слайд 14И с раствором гидроксида натрия и с серной кислотой реагирует
1)ВаO

2) Cr2O3
3) SiO2
4) MgO
Слайд 15Гидроксиды
Основные – основания (щелочи и нерастворимые в воде)
Кислотные – кислоты кислородсодержащие
Амфотерные

Слайд 16Только кислоты расположены в ряду
1)HNO3, Ca(NO3)2, NO2
2)KHCO3, Ba(HSO4)2, Zn(OH)Cl
3)HNO2, HNO3, CH3COONa
4)H2S, Н2SO3,

CH3COOH
Слайд 17Оцените правильность следующих суждений:
А) Гидроксиды по свойствам делятся на кислоты, основания и

амфотерные гидроксиды.
Б) Гидроксиды элементов главных подгрупп первой и второй групп Периодической системы – растворимые основания (щелочи).
1)верно только А
2)верно только Б
3)верны оба суждения
4)оба суждения неверны
Слайд 18Щелочи – растворимые в воде основания
Щелочи образуют металлы 1 группы главной подгруппы

(щелочные металлы) и щелочноземельные металлы (Ca, Sr, Ba)
Примеры: NaOH, Ca(OH)2
Слайд 19Свойства щелочей
Реагируют с кислотами:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Реагируют с

кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O
Реагируют с растворами солей, если выпадает осадок:
2NaOH+ CuSO4 = Cu(OH)2↓ + Na2SO4
Реагируют с металлами, образующими амфотерные оксиды и гидроксиды:
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + Н2
Слайд 20Нерастворимые в воде основания
Реагируют с кислотами:
Mg(OH)2 + 2HNO3 = Mg(NO3)2 +2H2O
Разлагаются при
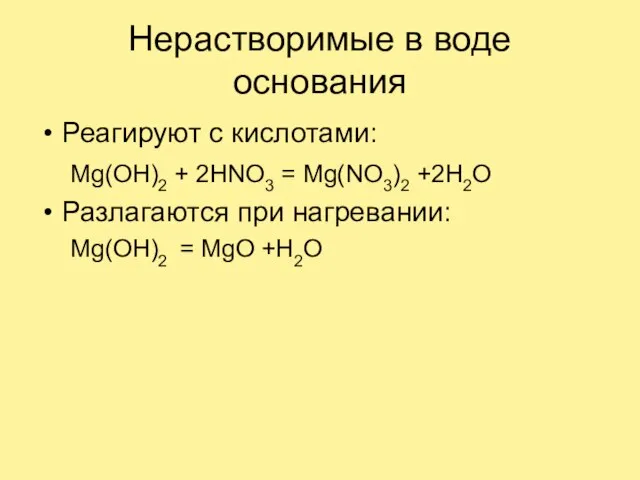
нагревании:
Mg(OH)2 = MgO +H2O
Слайд 21Кислотные гидроксиды – кислородсодержащие кислоты
Реагируют с основаниями:
KOH + HNO3 = KNO3 +

H2O
Реагируют с основными оксидами:
MgO + H2SO4 = MgSO4 + H2O
Реагируют с металлами, стоящими в ряду напряжений до водорода:
Mg + H2SO4 = MgSO4 + H2
Реагируют с солями:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
Слайд 22Амфотерные гидроксиды
Реагируют с кислотами, проявляя свойства оснований:
Al(OH)3 + 3HCl = AlCl3 +

3H2O
Реагируют со щелочами, проявляя свойства кислот:
Al(OH)3 + NaOH = Na[Al(OH)4]
Слайд 23Гидроксид натрия не взаимодействует с
1)CuCl2
2)SO2
3)PbS
4)HNO3

Слайд 24Гидроксид натрия реагирует со всеми веществами ряда:
1)Zn, Na 2CO3, CuO
2)CO2, H3 PO4

CuO
3)S O3, H3PO 4, AI2O3
4)SO3, MgO, H3PO4,
Слайд 25Гидроксид калия реагирует со всеми веществами группы
1)Zn, SiO2, H2O
2)HNO3, Na2CO3, Mg
3)CuSO4, SO3,

H3PO4
4)CuO, Cа(OH)2, N2O5
Слайд 26В ряду превращений:
CuO→CuCl2→Cu(OH)2 вещества X и Y соответственно
1)НСl и

NaOH
2)HCl и Fe(OH)3
3)NaCl и Н2O
4)Cl2 и H2O
Слайд 27В ряду превращений
NaOH→Na 2CO3→CO2
веществa X и Y соответственно
1)Н2CO3
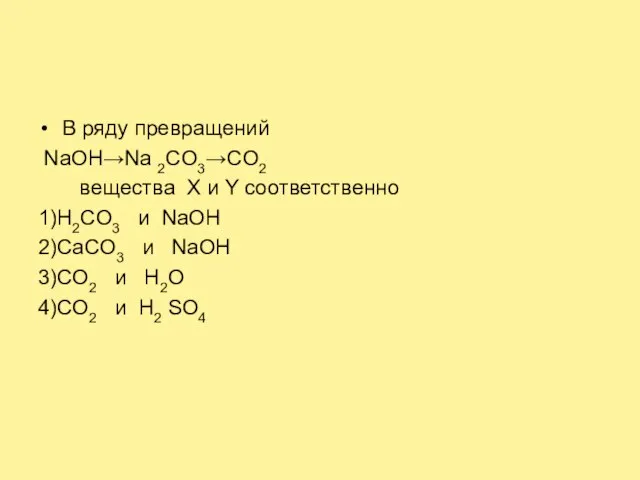
и NaOH
2)CaCO3 и NaOH
3)CO2 и H2O
4)CO2 и H2 SO4
Слайд 28Каждое из перечисленных веществ: CuCl2, SO3, H3PO4, Zn(OH)2
реагирует с
1)серной кислотой 2)водой

3)гидроксидом натрия 4)оксидом углерода(VI)
Слайд 29 При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется
1)

ZnO
2) Zn(OH)2
3) Na2ZnO2
4)Na2[Zn(OH)4]




























 Презентация на тему Опасна ли гроза
Презентация на тему Опасна ли гроза Redaktiruemy_beydzh
Redaktiruemy_beydzh Физкультура. Виды плаванья
Физкультура. Виды плаванья О некоторых итогах участия МИП СФО в реализации государственных программ Фонда содействия развитию МП в НТС
О некоторых итогах участия МИП СФО в реализации государственных программ Фонда содействия развитию МП в НТС Письмо пером - за и против
Письмо пером - за и против Tin cup design
Tin cup design Транспорт. Виды транспорта
Транспорт. Виды транспорта Новый стандарт: обучаем и учимся
Новый стандарт: обучаем и учимся Конституционное право. Принцип дисконтинуитета. Перспективы развития в Российской Федерации
Конституционное право. Принцип дисконтинуитета. Перспективы развития в Российской Федерации Виды рабочей одежды
Виды рабочей одежды Я люблю тебя, Сакский район!
Я люблю тебя, Сакский район! Что такое значение?От П.Грайса к теории игр.
Что такое значение?От П.Грайса к теории игр. Тема лекции:«Прикладная информатика в табличном процессоре»
Тема лекции:«Прикладная информатика в табличном процессоре» Структура Комитета торговли Министерства экономического развития и торговли Республики Казахстан
Структура Комитета торговли Министерства экономического развития и торговли Республики Казахстан Презентация на тему Информация в природе, обществе и технике
Презентация на тему Информация в природе, обществе и технике Основы коммуникативной компетентности педагогов
Основы коммуникативной компетентности педагогов Хочу отдыхать
Хочу отдыхать Урок по рассказам И.А. Бунина о любви
Урок по рассказам И.А. Бунина о любви Русская изба – поэтапное рисование
Русская изба – поэтапное рисование Известные люди Австрии
Известные люди Австрии 3-й КОНКУРСНЫЙ НАБОР ПРОЕКТНЫХ ПРЕДЛОЖЕНИЙПОДГОТОВКА ПРИЛОЖЕНИЯ B: БЮДЖЕТ И ПРИЕМЛЕМОСТЬ РАСХОДОВБеларусь, 30.03.2012 – 05.04.2012
3-й КОНКУРСНЫЙ НАБОР ПРОЕКТНЫХ ПРЕДЛОЖЕНИЙПОДГОТОВКА ПРИЛОЖЕНИЯ B: БЮДЖЕТ И ПРИЕМЛЕМОСТЬ РАСХОДОВБеларусь, 30.03.2012 – 05.04.2012 Викторина по произведениям А.П.Чехова « Смешные рассказы»
Викторина по произведениям А.П.Чехова « Смешные рассказы» Объединение «Грамматландия» Составила: Мануйлова Н. В. 2011 г.
Объединение «Грамматландия» Составила: Мануйлова Н. В. 2011 г. ЮТА (2)
ЮТА (2) Многообразие компьютеров
Многообразие компьютеров Похищение человека
Похищение человека Понятие и особенности административно правовой нормы
Понятие и особенности административно правовой нормы Техника мраморирования в современном дизайне
Техника мраморирования в современном дизайне