Содержание
- 2. Коллигативные свойства растворов – это свойства, которые зависят от числа частиц растворенного в веществе и не
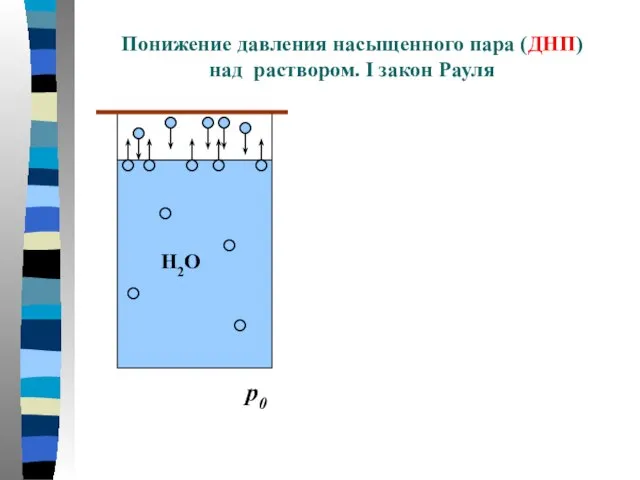
- 3. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля p0
- 4. ↑t ↑p0 H2O: 00C – 4,6 мм рт. ст. 200C – 17,4 мм рт. ст. 1000C
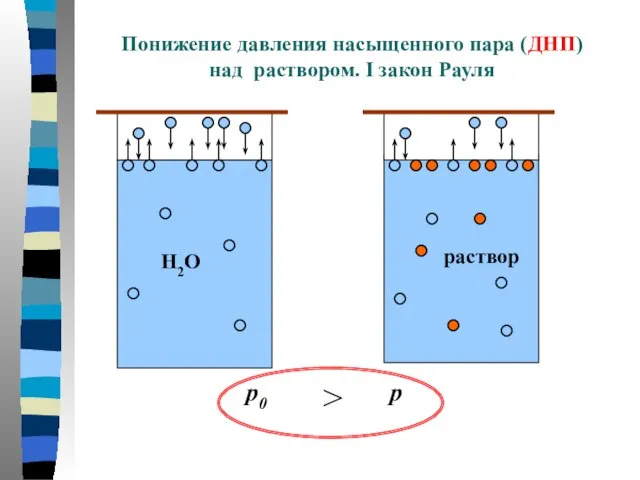
- 5. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля p0 p >
- 6. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
- 7. II закон Рауля ΔТзамерзания = Тзамерзания р-ля – Тзамерзания р-ра = ΔТз ΔТкипения = Ткипения р-ра
- 8. II закон Рауля Чем больше концентрация растворенного вещества, тем выше Тк и ниже Тз раствора. ΔТк
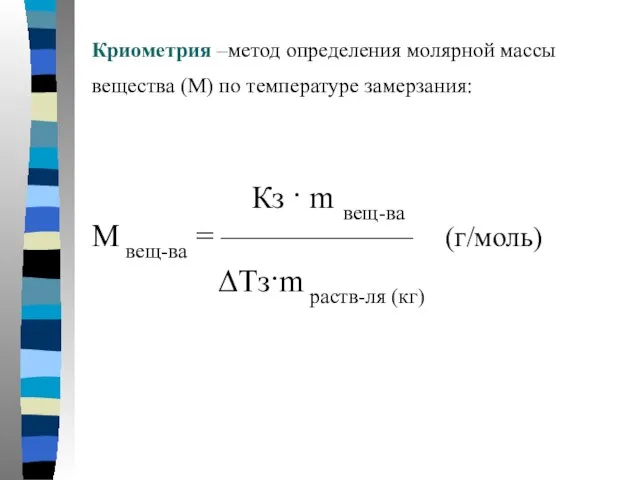
- 9. Криометрия –метод определения молярной массы вещества (М) по температуре замерзания: Кз · m вещ-ва М вещ-ва
- 10. Осмос. Осмотическое давление Осмос – это односторонняя диффузия воды через полупроницаемою мембрану из растворителя в раствор
- 12. Значение осмоса ⮚ упругость, тургор клеток ⮚ эластичность тканей, форма органов ⮚ усвоение пищи, образование лимфы,
- 13. Осмотическое давление крови Состав плазмы крови: 90 % Н2О, 7 % белков, 0,9 % эл-отв (>
- 14. Осмотическое давление, которое зависит от белков называется онкотическим (0,03 – 0,04 атм.). При длительном голодании, болезни
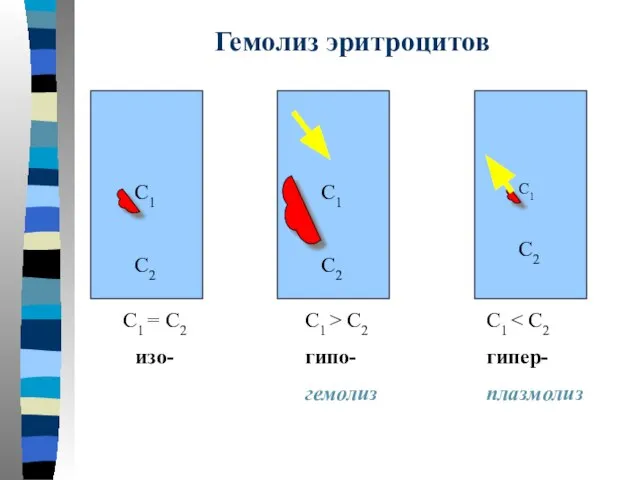
- 15. Гемолиз эритроцитов С1 С2 С1 С2 С1 С2 С1 = С2 изо- С1 > С2 гипо-
- 16. Плазмолиз – явление сжатия, высушивания клеток в гипертоническом растворе. Идет осмос воды из клетки в раствор,
- 17. Коллигативные свойства растворов электролитов В растворах электролитов число частиц больше из-за диссоциации. Вант-Гофф дал поправочный изотонический
- 18. Для сильных электролитов (α≈1): α=(i-1)/(n-1) NaCl ↔ Na+ + Cl- 2 иона => n=2, i=2 при
- 20. Скачать презентацию













 Перспектива. Построение объектов
Перспектива. Построение объектов Участие в проектах
Участие в проектах Школьная форма
Школьная форма Учитель начальных классов МОУ СОШ №8 Оладько Валентина Николаевна
Учитель начальных классов МОУ СОШ №8 Оладько Валентина Николаевна Блок системы взаимоотношений
Блок системы взаимоотношений Мойте руки перед едой или простые правила гигиены
Мойте руки перед едой или простые правила гигиены Українська блоґосфера і ведення блоґів
Українська блоґосфера і ведення блоґів Обменять значения двух переменных, используя третью (буферную) переменную
Обменять значения двух переменных, используя третью (буферную) переменную Студенчество - дивная пора
Студенчество - дивная пора Что такое бездушие
Что такое бездушие Аффект неадекватности Неймарк – показатель капитализации человеческих ресурсов
Аффект неадекватности Неймарк – показатель капитализации человеческих ресурсов Национальные особенности продаж
Национальные особенности продаж Военная техника ВОВ
Военная техника ВОВ В.Н.ДеминТАЙНЫ ВСЕЛЕННОЙ
В.Н.ДеминТАЙНЫ ВСЕЛЕННОЙ Этапы сопровождения семей, имеющих ребенка с РАС
Этапы сопровождения семей, имеющих ребенка с РАС Василий Макарович Шукшин 10 класс
Василий Макарович Шукшин 10 класс Резьба
Резьба Пороки дерева и древесины
Пороки дерева и древесины Материальные и информационные модели
Материальные и информационные модели Мое хобби - мой бизнес. Свадебные мелочи
Мое хобби - мой бизнес. Свадебные мелочи РЕФЛЕКСИЯ
РЕФЛЕКСИЯ Смерть и бессмертие
Смерть и бессмертие Автоматизация редактирования
Автоматизация редактирования Живопись старых мастеров. Техника и технология
Живопись старых мастеров. Техника и технология Системы безопасности
Системы безопасности Правоотношения и субъекты права
Правоотношения и субъекты права Виды спектров. Спектральный анализ
Виды спектров. Спектральный анализ Английский язык вне Англии
Английский язык вне Англии