Слайд 2
План
1. Строение КС
2. Название КС
3. Химическая связь в КС
4. Диссоциация КС. Константа
нестойкости
(К нест) комплексного иона.
Слайд 3Понятие КС
Комплексными называются соединения, в которых есть химическая связь, образованная по

донорно-акцепторному механизму.
Пример: ион аммония [NH4]+ :
NH3 + H+ → [NH4]+
Атом N – донор электронной пары;
ион H+ - акцептор
Слайд 4Строение КС. Координационная теория А.Вернера.
КC состоят из внутренней и внешней сферы(внутренняя сфера

заключается в квадратные скобки[…]).
Внутренняя сфера КС состоит из центрального иона-комплексообразователя и лигандов. Лиганды – кислотные остатки или нейтральные молекулы –NH3,H2O , CO, NO, которые присоединены, т.е. координированы, к комплексообразователю
( центральному иону).
Слайд 5
II. Название комплексных соединений.
Название числительных :
2 – ди, 3 – три, 4
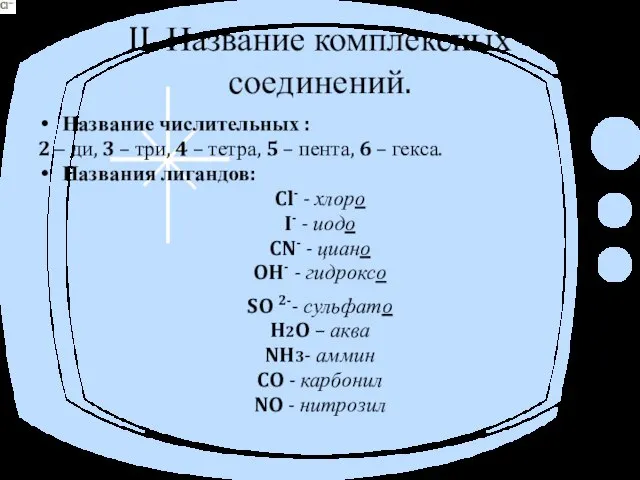
– тетра, 5 – пента, 6 – гекса.
Названия лигандов:
Cl- - хлоро
I- - иодо
CN- - циано
OH- - гидроксо
SO 2- - сульфато
H2O – аква
NH3- аммин
CO - карбонил
NO - нитрозил
Слайд 6Название КС катионного типа […]+
1.Внешняя среда
2.Лиганды и их кол-во
3. Центральный ион
![Название КС катионного типа […]+ 1.Внешняя среда 2.Лиганды и их кол-во 3.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-5.jpg)
по-русски в родительном падеже
Пример:
[ Ni+3(H2O)05Cl-]+Cl- - Хлорид хлоропентааква- никеля(II)
[Zn(H2O)4]SO4 - Сульфат тетрааквацинка
[Ag(NH3)2]Cl - Хлорид диамминсеребра
Слайд 7Название КС анионного типа […]-
1.Лиганды и их кол-во
2.Центральный ион (лат.) с окончанием
![Название КС анионного типа […]- 1.Лиганды и их кол-во 2.Центральный ион (лат.)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-6.jpg)
«ат»
3.Внешняя сфера по-русски в родительном падеже
Пример:
K3[Fe+3(CN)-6]3- - гексацианоферрат(III) калия
Na2[HgI4] - тетраиодомеркурат(II) натрия
K3[Al(OH)6] - гексагидроксоалюминат калия
Слайд 8
Название внутрикомплексных солей […]0
1.Лиганды, их кол-во
2.Центральный ион по-русски в именительном падеже
Пример :
[Pt2+(NH3)2Cl2]0
![Название внутрикомплексных солей […]0 1.Лиганды, их кол-во 2.Центральный ион по-русски в именительном](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-7.jpg)
- дихлородиамминплатина (II)
Слайд 9Химическая связь в КС.
Если КС растворимо в воде, то на внутреннюю

и внешнюю сферу оно диссоциирует полностью. Внутренняя сфера КС – слабый электролит – диссоциирует обратимо и ступенчато. На каждой ступени диссоциации внутренней сферы из неё выходит один лиганд. Даже 1-ая ступень диссоциации КС идет слабо, а каждая последующая ступень протекает еще слабее.
Константа равновесия для диссоциации комплексного иона называется константой нестойкости К нест.
Слайд 10Пример:
K2[HgI4] → 2K+ +[HgI4]2-
Диссоциация комплексного иона:
1.Ступень первая
[HgI4]2- ↔ [HgI3]- + I-
![Пример: K2[HgI4] → 2K+ +[HgI4]2- Диссоциация комплексного иона: 1.Ступень первая [HgI4]2- ↔](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-9.jpg)
; Kн 1;
2.Ступень вторая
[HgI3]3 ↔ [HgI2]0 + I- ; Kн 2;
Слайд 11Окислительно-восстановительные реакции (ОВР)
План:
1. Понятие ОВР
2. Типичные окислители и восстановители
3. Окислительно-восстановительная двойственность (ОВД)
4.

Метод электронного баланса
5. Метод полуреакций
Слайд 12Понятие ОВР
I. ОВР – реакции, протекающие с изменением степени окисления элементов.
Окислители принимают

электроны и их степень окисления уменьшается.
Восстановители отдают электроны и их степень окисления увеличивается.
Отдача электронов – процесс окисления; принятие электронов – процесс восстановления.
Слайд 13Типичные окислители:
Элементы в max степени окисления
( HNO3, KMnO4, K2Cr2O7)
степень окисления

= номер группы.
Ионы Меn+ в max степени окисления
(Cu2+, Ni3+)
F20, O20, O30
Слайд 14Типичные восстановители:
Элементы в минимальной степени окисления (KI, H2S, NH3)
Ме0 (металлы) (Zn0, Mg0)
H20

Слайд 15Окислительно-восстановительная двойственность (ОВД)
Элементы в промежуточной степени окисления (HNO2, Na2SO3)
Ионы Mem+ в промежуточной

степени окисления (Cu+, Fe2+)
Неметаллы, кроме F2, O2, O3,H2, (S0,P0,C0)
III. ОВД
Элементы в промежуточной степени окисления могут быть и окислителями, и восстановителями ( в зависимости от того, с чем они реагируют)
Пример:
2SO2 + O2 → 2SO3
В-ЛЬ ОК-ЛЬ
SO2 + 2H2 → S + 2H2O
ОК-ЛЬ В-ЛЬ
Слайд 16IV. Метод электронного баланса
Метод используется, если реакция протекает в газах или в

твердой фазе.
Пример: N-3H3 + O20 → N20 + H2O -2
В-ЛЬ ОК-ЛЬ
2N-3 -6e- → N20 12 2
O20 +4e- → 2O-2 3
4NH3 + 3O20 → 2N20 + 6H2O
Проверка: Ме, неМе, H, O
Слайд 17V. Метод полуреакций
Метод полуреакций используется для ОВР, протекающих в водном растворе.
В нем

выписывается не просто элемент, изменивший степень окисления, а ион или молекула, в составе которого есть этот элемент.
Для уравнивания атомов кислорода и водорода в этом методе можно использовать :
H+, H2O, OH- : в кислой среде H+, H2O;
в нейтральной среде: H2O, OH-, H+
в щелочной среде: H2O, OH-
Слайд 18Правила уравнивания атомов
«O» и «Н»:
а) кислая среда: в той части полуреакции,

где мало атомов «О» дописывают+ H2O(столько молекул воды, сколько не хватает атомов «О»), а по другую сторону стрелочки дописывают ионы «Н+», столько, сколько их напротив.
Пример:
MnO4 - + 8H+ +5e- → Mn2+ + 4H2O2+
Затем считают суммарный заряд слева и справа и находят их разницу (это количество электронов)
Слайд 19б) нейтральная среда:
если справа и слева в полуреакции разное количество атомов «О»,

то слева всегда добавляют воду (столько молекул, сколько лишних атомов «О» или сколько не хватает атомов «О»). Справа же могут быть и H+, и OH-.
Пример:
MnO4- + 2H2O +3e- → MnО2 + 4OH-
Затем считают заряд слева, заряд справа и их разницу (это количество электронов).




![Название КС катионного типа […]+ 1.Внешняя среда 2.Лиганды и их кол-во 3.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-5.jpg)
![Название КС анионного типа […]- 1.Лиганды и их кол-во 2.Центральный ион (лат.)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-6.jpg)
![Название внутрикомплексных солей […]0 1.Лиганды, их кол-во 2.Центральный ион по-русски в именительном](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-7.jpg)

![Пример: K2[HgI4] → 2K+ +[HgI4]2- Диссоциация комплексного иона: 1.Ступень первая [HgI4]2- ↔](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/365606/slide-9.jpg)









 «Настольная кукла»
«Настольная кукла» Форматы графических файлов
Форматы графических файлов Pets and presidents
Pets and presidents Елена Александровна Благинина
Елена Александровна Благинина Легкая атлетика. Определение лёгкой атлетики
Легкая атлетика. Определение лёгкой атлетики Основные требования к кандидатской диссертацииКак написать хорошую диссертацию
Основные требования к кандидатской диссертацииКак написать хорошую диссертацию Презентация на тему Наполеон и Кутузов по Толстому
Презентация на тему Наполеон и Кутузов по Толстому Начертательная геометрия
Начертательная геометрия Межличностные отношения
Межличностные отношения Затратный подход. Метод оценки стоимости объекта с учётом износа
Затратный подход. Метод оценки стоимости объекта с учётом износа Имя числительное (3 класс)
Имя числительное (3 класс) «1С-Отчетность»удобный способэлектронной отчетности
«1С-Отчетность»удобный способэлектронной отчетности Электронная коммерция в туризме
Электронная коммерция в туризме Тундра 3 класс
Тундра 3 класс Многие песни А. Пахмутовой незаметно вошли в нашу жизнь, они активно воздействуют на людей- воспитывают их мысли и чувства, помогаю
Многие песни А. Пахмутовой незаметно вошли в нашу жизнь, они активно воздействуют на людей- воспитывают их мысли и чувства, помогаю Моя республикаТатарстан
Моя республикаТатарстан Понятие, предмет, объект, субъект, история развития муниципального права
Понятие, предмет, объект, субъект, история развития муниципального права Государственная программа "Образование и развитие инновационной экономики: внедрение современной модели образования в 2009 - 2012 г
Государственная программа "Образование и развитие инновационной экономики: внедрение современной модели образования в 2009 - 2012 г Мой любимый детский сад Журавушка
Мой любимый детский сад Журавушка Олимпийский центр «Вентспилс»
Олимпийский центр «Вентспилс» Использование результатов ОГЭ и ЕГЭ в повышении качества образования по иностранному языку
Использование результатов ОГЭ и ЕГЭ в повышении качества образования по иностранному языку Молодіжні субкультури
Молодіжні субкультури УЧИТЕЛЯ
УЧИТЕЛЯ Презентация на тему Продажа имения старой графини» математическая игра для10-11 классов
Презентация на тему Продажа имения старой графини» математическая игра для10-11 классов  Что в имени тебе моем...?
Что в имени тебе моем...? dr
dr Мастер-класс по изготовлению куклы-дергунчика
Мастер-класс по изготовлению куклы-дергунчика Водоросли
Водоросли