Слайд 2Что обозначается этими величинами в химии?
ω, См, X

Слайд 3Цели урока:
расширить и систематизировать представления о способах выражения концентрации растворов;
изучить новые способы

выражения концентраций растворов;
учиться применять полученные теоретические знания при решении задач;
развивать интеллектуальные умения и навыки.
Слайд 4Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества

(не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями.
Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Слайд 5Способы выражения концентрации растворов
1 Массовая доля (весовые проценты,
процентная концентрация)
2

Объёмная доля
3 Молярность (молярная концентрация)
4 Мольная доля
5 Моляльность (моляльная концентрация)
6 Титр раствора
7 Нормальность (молярная концентрация эквивалента)
8 Растворимость вещества
Слайд 6Процентная концентрация, массовая доля растворённого вещества
Массовая доля растворённого вещества-это отношение массы растворённого

вещества к массе раствора.
Для расчёта процентной концентрации используется формула:
Раствор состоит из растворённого вещества и растворителя. Массу раствора можно определить по формуле:
Слайд 7В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его

концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Часто для выражения концентрации (например, серной кислоты в аккумуляторах) пользуются просто их плотностью. Распространены ареометры предназначенные для определения концентрации растворов веществ.
Слайд 8Зависимость плотности растворов H2SO4 от её массовой доли в водном растворе при

20°C
Слайд 9Объёмная доля
Объемная доля — отношение объёма растворённого вещества к объёму раствора.

Объёмная доля измеряется в долях единицы или в процентах.
где: V (в-ва) — объём растворённого вещества, л;
V(р-ра) — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора.
Слайд 10Молярность
(молярная концентрация)
Молярность — число молей растворённого
вещества в единице объёма

раствора.
где ν- количество растворённого вещества, моль;
V- объём раствора, л
Молярность чаще выражают в моль/л или ммоль/л. Возможны следующие обозначения молярной концентрации - С, См, М.
Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным (0,5М).
Слайд 11Мольная доля
Мольная доля (X) — отношение количества молей данного компонента к

общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
X = ν(в-ва)\ ∑ν(в-в)
ν — количество компонента, моль;
∑ν — сумма количеств всех компонентов,
моль.
Слайд 12Моляльность
(моляльная концентрация)
Моляльность — число молей растворённого вещества в 1кг

растворителя.
Измеряется в моль/кг, Так, раствор с концентрацией
0,5 моль/кг называют 0,5-моляльным.
Св = ν /m(р-ля),
где: ν— количество растворённого вещества, моль;
m (р-ля) — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярность и моляльность величины различные. Прежде всего, при выражении концентрации в моляльности, в отличие от молярности, расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярности, не зависит от температуры.
Слайд 13Титр раствора
Титр раствора — масса растворённого вещества в
1 мл раствора.

Т=m(в-ва)/V(р-ра),
где: m(в-ва) — масса растворённого вещества, г;
V(р-ра) — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Слайд 14Нормальность (молярная концентрация эквивалента)
Нормальность (Сн)— число эквивалентов данного вещества в одном литре

раствора. Нормальность выражают в моль-экв/л. Часто концентрацию таких растворов выражают как «н». Например, раствор содержащий 0,1 моль-экв/л называют децинормальным и записывают как 0,1н.
Сн =Э/ V (р-ра), где:
Э — эквивалент, моль-экв;
V — общий объём раствора, л;
Сн(щёлочи) ∙V(щёлочи)= Сн(кислоты)∙ V(кислоты)
Слайд 15Коэффициент растворимости
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через

так называемый коэффициент растворимости или просто растворимость вещества.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
Кр = m(в-ва) / m(р-ля)
Растворимость вещества показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
р = (mв-ва / mр-ля) ∙ 100%
Слайд 16Задачи
1.Определите молярную концентрацию хлорида натрия в 24%-ном растворе его плотностью
1,18 г/мл.

(Ответ - 4,84 М )
2. Определите молярную концентрацию соляной кислоты в 20%-ном растворе плотностью 1,098. (Ответ - 6М)
3. Определите молярную концентрацию азотной кислоты в 30%-ном растворе ее плотностью 1,18 г/мл. (Ответ - 5,62 М )
4. Вычислите массовую долю гидроксида калия в водном растворе с концентрацией 3М и плотностью 1,138 г/мл. (Ответ - 15 %)
5. Сколько мл 56 %-ного раствора серной кислоты ( плотность-1,46г/мл) нужно для приготовления 3 л 1М раствора? (Ответ - 360 мл)















 rvex5e0qf2kcfgmz01w1i7ity29jz3lp
rvex5e0qf2kcfgmz01w1i7ity29jz3lp Валютные операции
Валютные операции Общеметодологические вопросы оценки эффективности инвестиций
Общеметодологические вопросы оценки эффективности инвестиций Становление и развитие саморегулирования в строительной деятельности: проблемы и предложения по их решению
Становление и развитие саморегулирования в строительной деятельности: проблемы и предложения по их решению Роман А.С. Пушкина «Евгений Онегин» и портретная живопись начала 19 века
Роман А.С. Пушкина «Евгений Онегин» и портретная живопись начала 19 века Презентация на тему Пиломатериалы
Презентация на тему Пиломатериалы Name and write
Name and write Задачи менеджмента организации (DZ)
Задачи менеджмента организации (DZ) Казачий фольклор 3 класс
Казачий фольклор 3 класс Сколько стран, столько денег
Сколько стран, столько денег Готовые дома
Готовые дома Построение видов
Построение видов V.CRM
V.CRM Контроль рассеивания отходов. 3 Любая вид отходов потенциально подвержен рассеянию Высокий риск – сухие отходы и погрузчики с фро
Контроль рассеивания отходов. 3 Любая вид отходов потенциально подвержен рассеянию Высокий риск – сухие отходы и погрузчики с фро Жизнь и творчество Чарльза Диккенса
Жизнь и творчество Чарльза Диккенса Презентация на тему Крещенские святки
Презентация на тему Крещенские святки 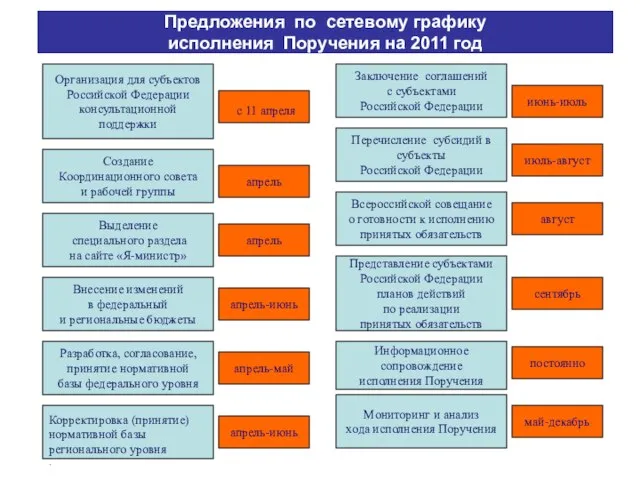 Предложения по сетевому графику исполнения Поручения на 2011 год Создание Координационного совета и рабочей группы апрель Внесение
Предложения по сетевому графику исполнения Поручения на 2011 год Создание Координационного совета и рабочей группы апрель Внесение Особенности организации и проведения школьного этапа Всероссийской олимпиады школьников по русскому языку Соловьева Т.В., предсе
Особенности организации и проведения школьного этапа Всероссийской олимпиады школьников по русскому языку Соловьева Т.В., предсе ОТ Тема № 2 - 1 __
ОТ Тема № 2 - 1 __ Искусственные острова
Искусственные острова Феномен сна. Сновидения
Феномен сна. Сновидения Вторжение на советскую землю началось На улицах осажденного Ленинграда.
Вторжение на советскую землю началось На улицах осажденного Ленинграда. Методы исследование слуховой функции
Методы исследование слуховой функции  Англия во второй половине XIX в
Англия во второй половине XIX в Гуманистические идеалы эпохи Возрождения
Гуманистические идеалы эпохи Возрождения Презентация на тему Семя его строение и значение
Презентация на тему Семя его строение и значение Правила поведения в условиях ЧС природного и техногенного характера
Правила поведения в условиях ЧС природного и техногенного характера Региональный опыт построения электронногоправительства в Амурской области
Региональный опыт построения электронногоправительства в Амурской области