Содержание
- 3. Общность свойств металлов 1) как правило, атомы металлов имеют небольшое число электронов на внешнем уровне электронной
- 4. Отличает металлическую связь от ковалентной отсутствие направленности связи и меньшая прочность. Энергия металлической связи в 3÷4
- 5. Мерой энергии связи – является величина энергии атомизации металла Энергия атомизации (Еатом.) – это та энергия,
- 6. Температура плавления – мера прочности связи в кристаллической решетке металла
- 7. Металлы – понятие химическое и физическое одновременно. В химическом аспекте металл это донор электронов (восстановитель):
- 8. а) высокая тепло-электропроводность; б) пластичность; в) металлический блеск (связанный с высокой отражательной способностью и непрозрачностью). В
- 9. Диаграмма состояния металлов в координатах (P,T)
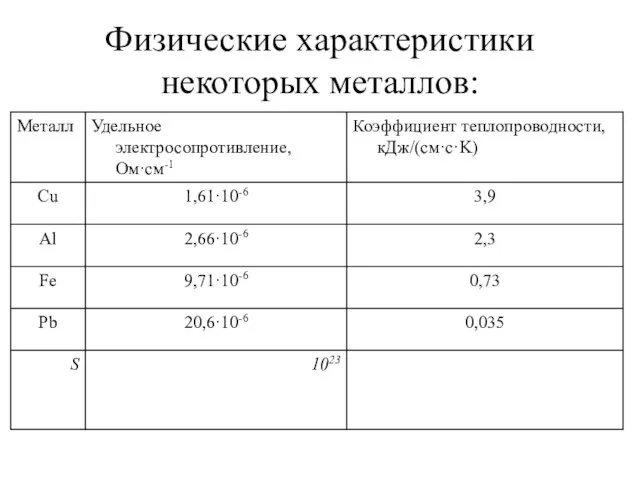
- 10. Физические характеристики некоторых металлов:
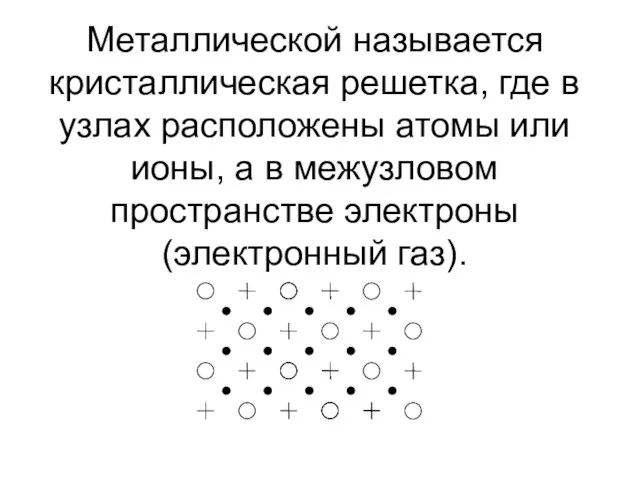
- 11. Металлической называется кристаллическая решетка, где в узлах расположены атомы или ионы, а в межузловом пространстве электроны
- 12. О свободе электронов: электроны выбиваются с поверхности металла: а) при облучении металлов ультрафиолетом – фотоэффект Столетова;
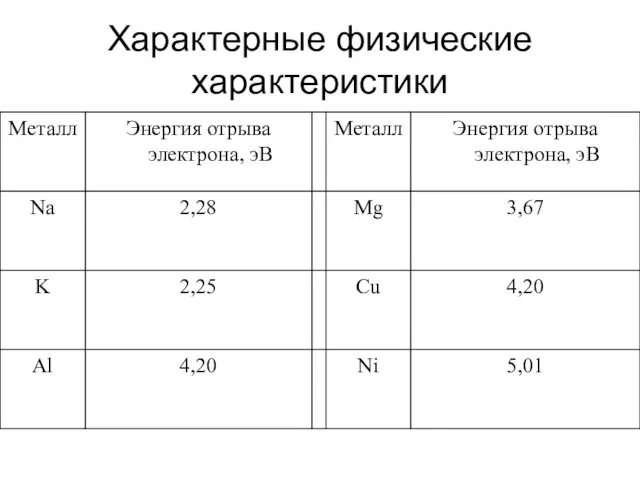
- 13. Характерные физические характеристики
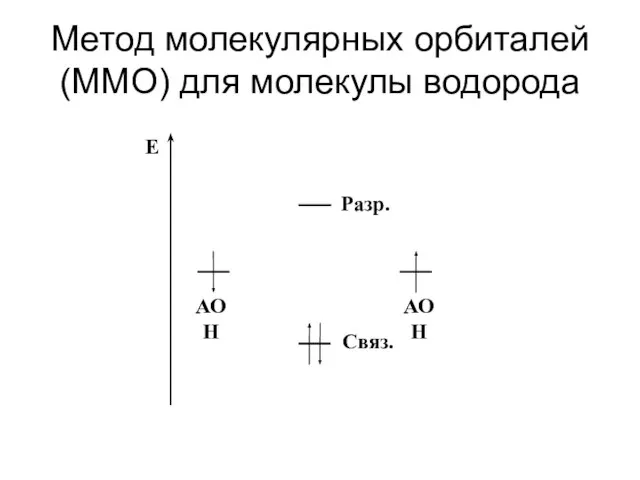
- 14. Метод молекулярных орбиталей (ММО) для молекулы водорода
- 15. При взаимодействии n – атомов зона разрешенных состояний расширяется, уменьшается разность между дискретными уровнями.
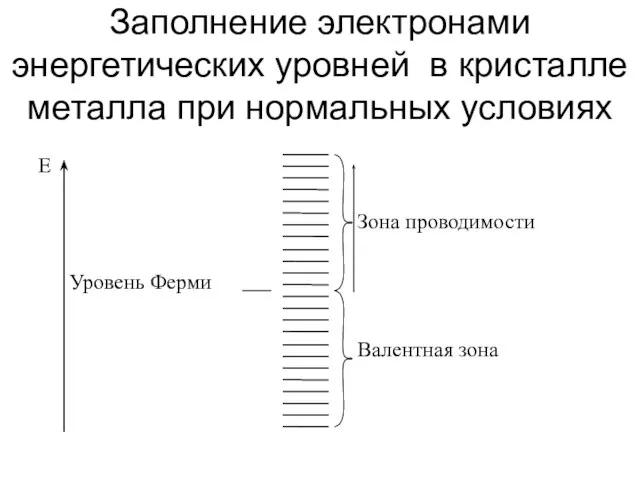
- 16. Заполнение электронами энергетических уровней в кристалле металла при нормальных условиях
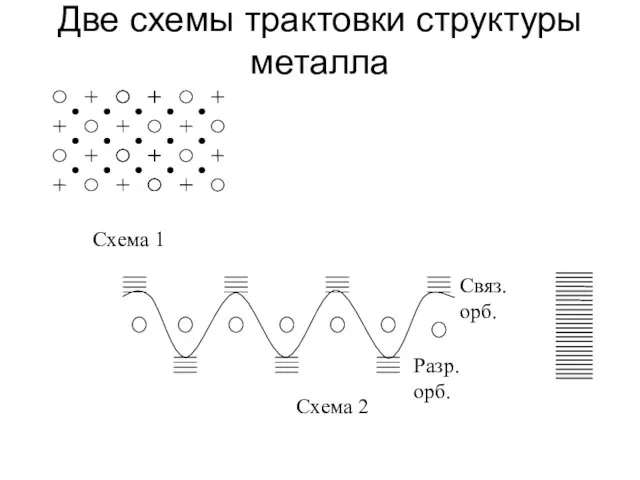
- 17. Две схемы трактовки структуры металла
- 18. Электронная проводимость Кристаллов простых веществ
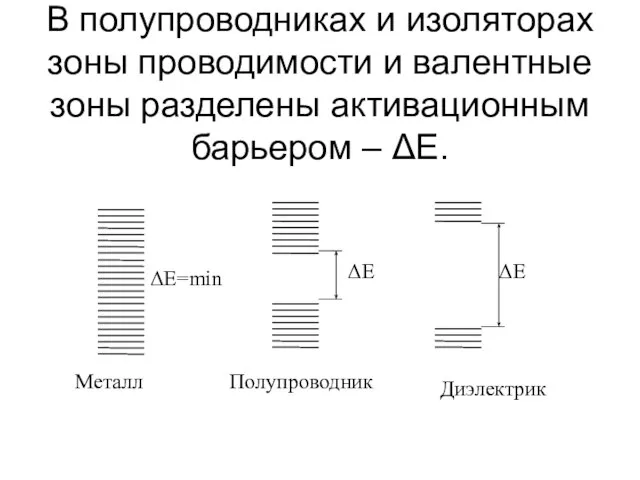
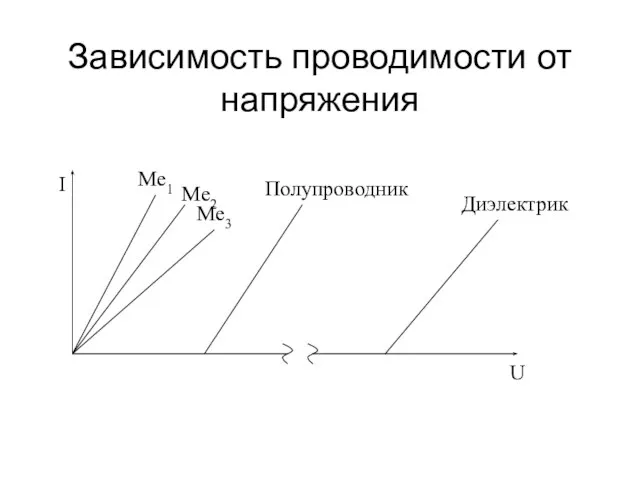
- 19. В полупроводниках и изоляторах зоны проводимости и валентные зоны разделены активационным барьером – ΔE.
- 20. Зависимость проводимости от напряжения
- 21. Получение металлов из руд. Различают: самородные металлы (Au, Ag, Hg, Cu, Pt); металлы в связанном состоянии
- 22. Остальные металлы получают химической переработкой руд следующими методами: Пирометаллургия – получение металлов при высокой температуре с
- 25. Применение металлов. Металлы применяют как конструкционные материалы и в виде комбинированных материалов (железобетон, металлокерамика, металлопластика и
- 26. Влияние чистоты металла на применение металлы высокой чистоты (для каждого металла своя степень чистоты) используются в
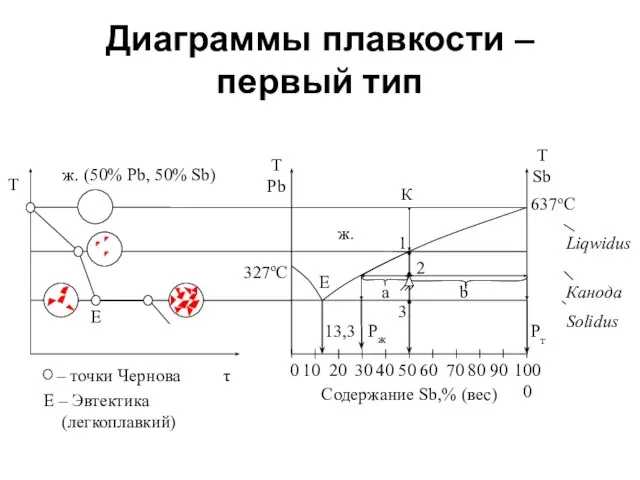
- 27. Сплавы. Выделяют сплавы трех модификаций: сплав – механическая смесь кристаллитов (простая эвтектика); твердые растворы; сплавы с
- 28. Диаграммы плавкости – первый тип
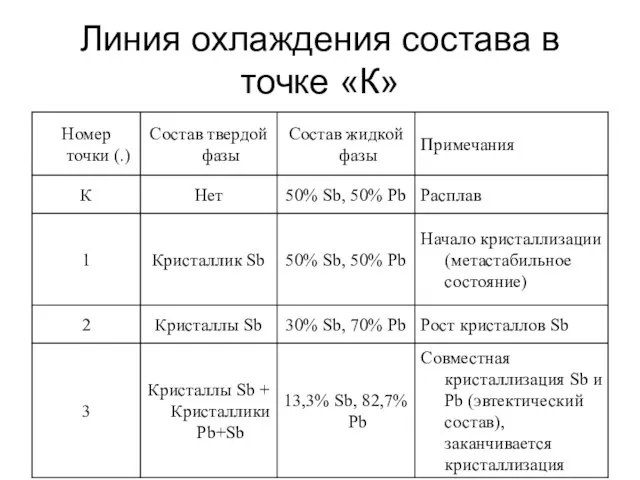
- 29. Линия охлаждения состава в точке «К»
- 30. Для точки 2 справедливо соотношение: – правило рычага
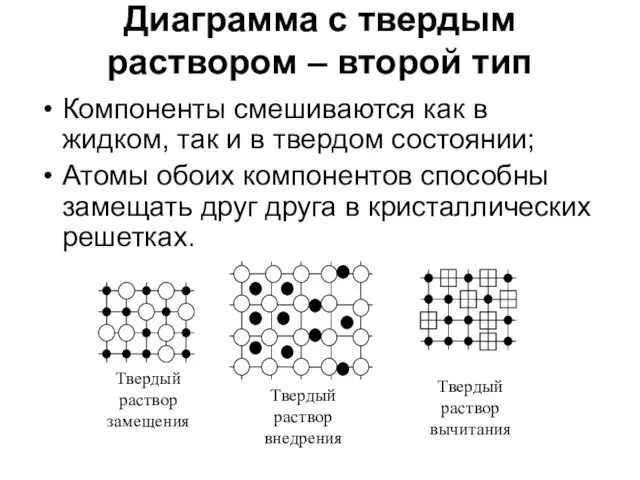
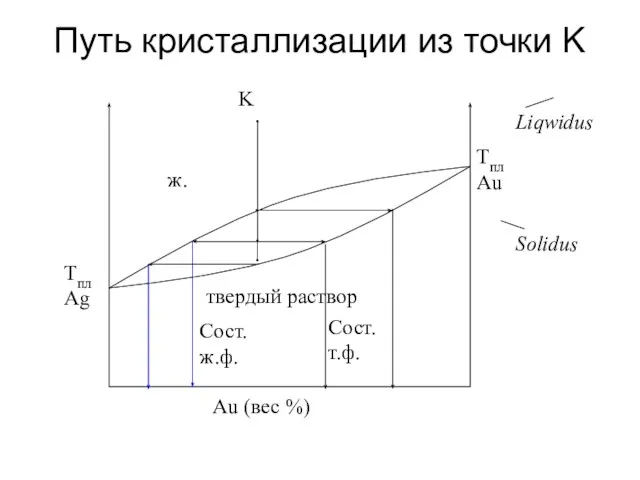
- 31. Диаграмма с твердым раствором – второй тип Компоненты смешиваются как в жидком, так и в твердом
- 32. Путь кристаллизации из точки K
- 33. Условие образования твердых растворов: компоненты должны иметь одинаковые по типу кристаллические решетки; различие в атомных размерах
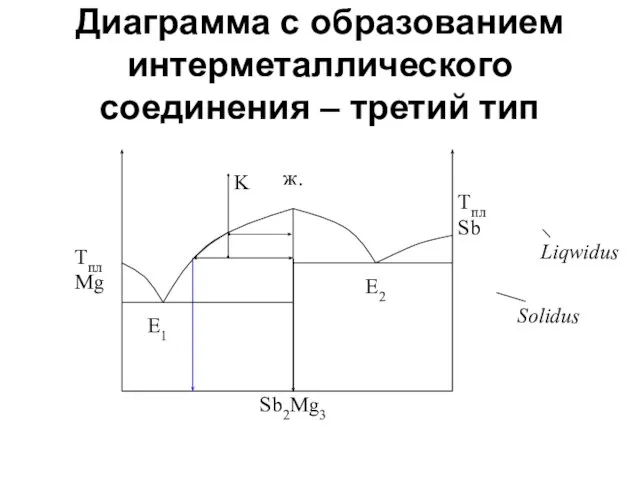
- 34. Диаграмма с образованием интерметаллического соединения – третий тип
- 35. Характерные особенности интерметаллического соединения атомы в решетке располагаются, упорядочено, т.е. атомы одного элемента закономерно и в
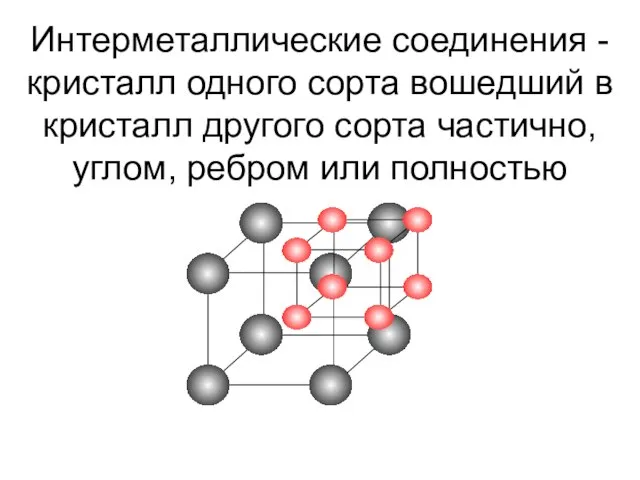
- 36. Интерметаллические соединения - кристалл одного сорта вошедший в кристалл другого сорта частично, углом, ребром или полностью
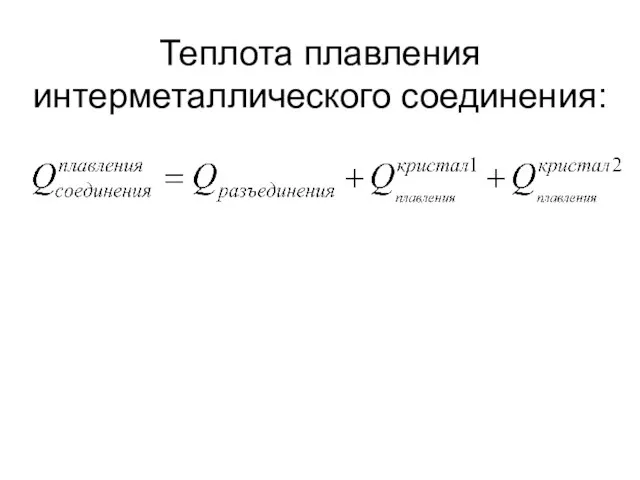
- 37. Теплота плавления интерметаллического соединения:
- 38. Химические свойства металлов s-,p-,d- элементов Для получения металлов использовался ряд активности металлов Бекетова: Легкость разряда катиона
- 40. Скачать презентацию





















 Money, Banking, and Financial Institutions
Money, Banking, and Financial Institutions Немой кинематограф. Вклад Александра Петровича Довженко
Немой кинематограф. Вклад Александра Петровича Довженко Проектирование и экспертиза образовательных систем
Проектирование и экспертиза образовательных систем Грибы-паразиты и меры борьбы с ними
Грибы-паразиты и меры борьбы с ними Права людини
Права людини Дизайн
Дизайн Управление собственностью. Стратегический менеджмент
Управление собственностью. Стратегический менеджмент культуры клеток
культуры клеток Перспективы ядерной энергетики
Перспективы ядерной энергетики Геометрические тела и окружающий мир
Геометрические тела и окружающий мир Творчество Евгения Рачёва
Творчество Евгения Рачёва Презентация на тему Промышленные загрязнения
Презентация на тему Промышленные загрязнения  Аналитика: Управленческая отчетность руководителя
Аналитика: Управленческая отчетность руководителя Здравствуй, школа!
Здравствуй, школа! Строевая подготовка
Строевая подготовка Мониторинг здоровья у занимающихся физической культурой − путь к успеху
Мониторинг здоровья у занимающихся физической культурой − путь к успеху Palkin_G_A_novaya
Palkin_G_A_novaya Пушкин "У лукоморья дуб зеленый"
Пушкин "У лукоморья дуб зеленый" Структура комплекса энтомофагов опыленной сливово-злаковой тли (Hyalopterus pruni) в условиях Беларуси
Структура комплекса энтомофагов опыленной сливово-злаковой тли (Hyalopterus pruni) в условиях Беларуси Основы финансовых вычислений
Основы финансовых вычислений Обучение работе с Microsoft Excel
Обучение работе с Microsoft Excel Буллинг в школе
Буллинг в школе Сокращение дробей
Сокращение дробей НАШИ БЛИЖАЙШИЕ СОСЕДИ
НАШИ БЛИЖАЙШИЕ СОСЕДИ Квалификационные требования к специалистам и проектным организациям в
Квалификационные требования к специалистам и проектным организациям в  Презентация на тему Стили речи
Презентация на тему Стили речи Косметическая линейка ватной продукции и влажных салфеток
Косметическая линейка ватной продукции и влажных салфеток Галактики. Многообразие галактик
Галактики. Многообразие галактик