Слайд 2 В образовании химической связи могут участвовать как пара, так и один электрон.
Состояние

электронов в молеку-лах соответствует принципам минимальной энергии, Паули и Гунда.
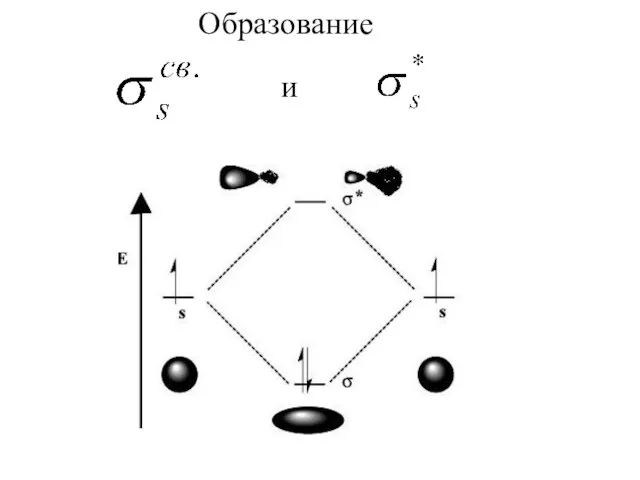
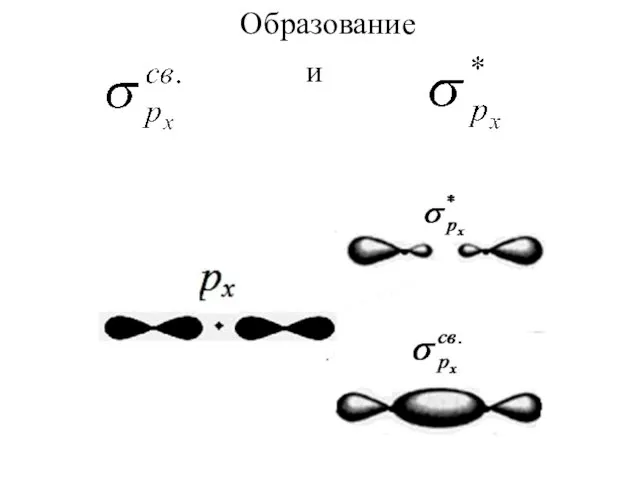
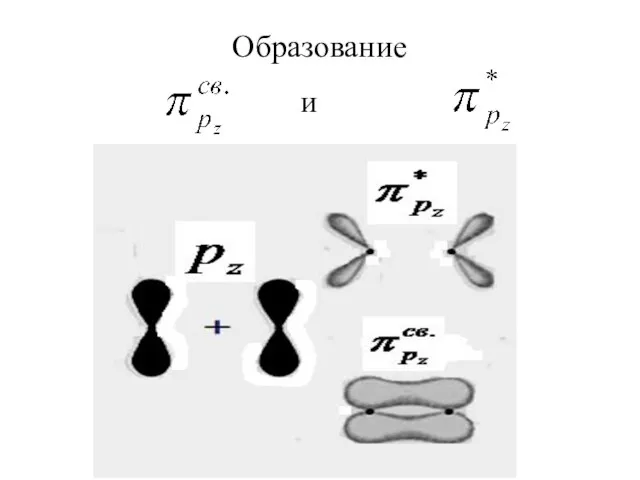
Слайд 3Молекулярные орбитали строятся из атомных орбиталей путем линейных комбинаций, т. е. путем

сложения и вычитания волновых функций. Из N атомных получают N молекулярных орбиталей.
Слайд 4При ЛКАО форму молекулярных
орбиталей можно предвидеть,
зная форму атомных орбиталей.
Во

втором периоде валентными
электронами являются только
s-, px, py , pz.
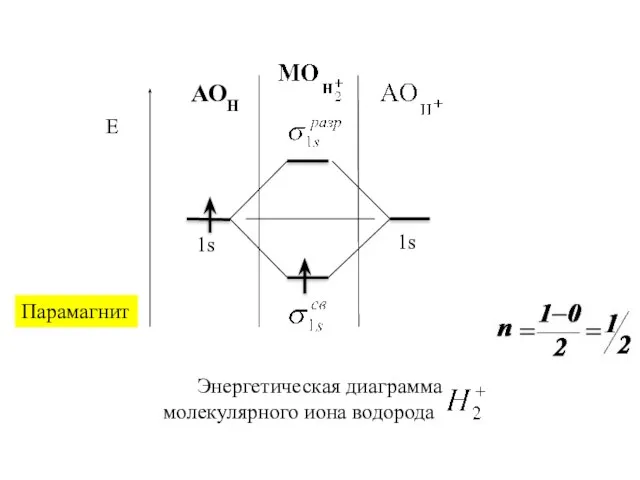
Слайд 8Из двух исходных АО получают две молекулярные орбитали: одну с меньшей энергией
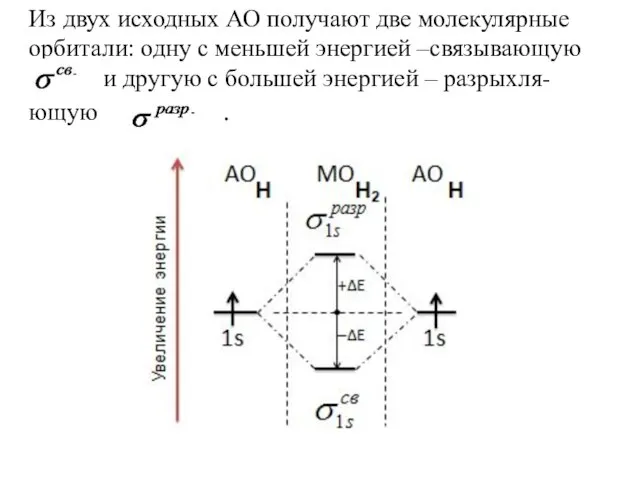
–связывающую
и другую с большей энергией – разрыхля-
ющую . .
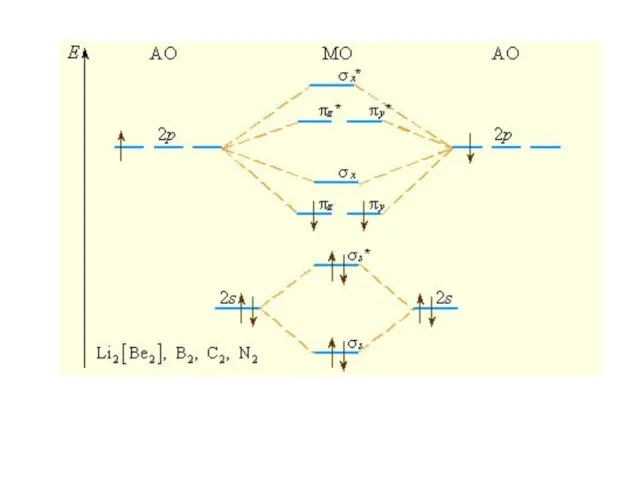
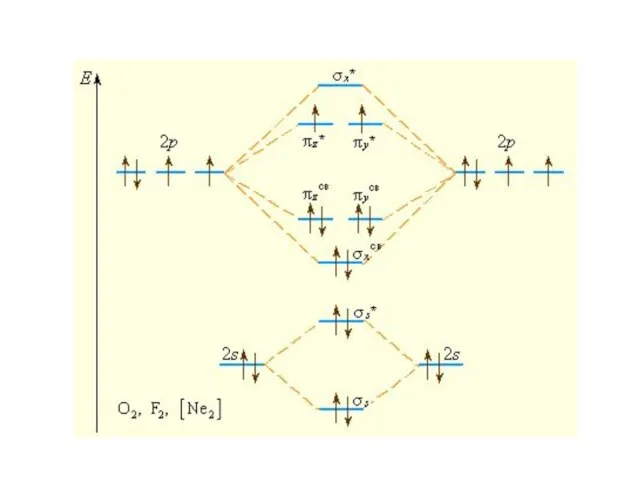
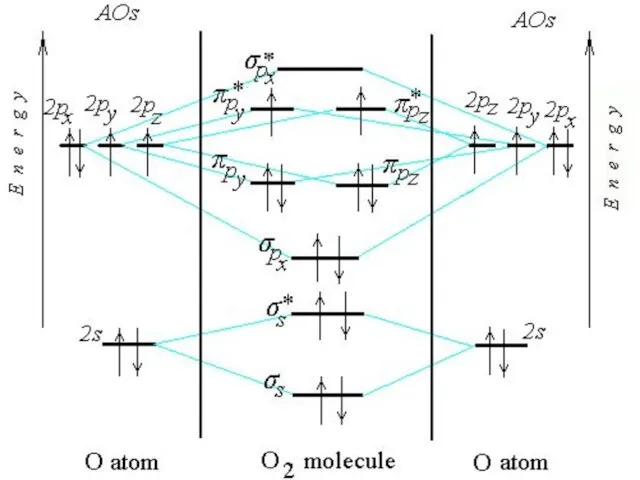
Слайд 11Последовательность располо-жения молекулярных орбиталей в зависимости от возрастания их энергии:
σ1s < σ1s*

< σ2s < σ2s* < πy = πz < σx < πy* = πz* < σx*
Слайд 14Изоэлектронные частицы
N2, CO, NO+
имеют одинаковый набор МО, одинаковую энергетическую последовательность, заселенность

электронами и одинаковый порядок связи




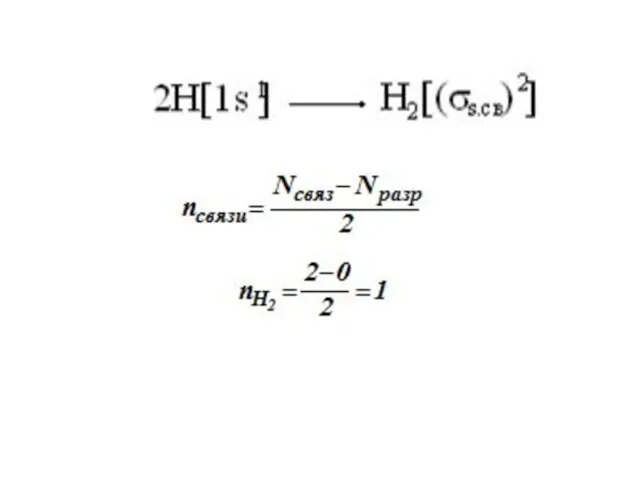


 English for Children
English for Children Молочные продукты
Молочные продукты Игра Эмоции и поступки
Игра Эмоции и поступки Доклад на тему:«Финансовый бюджет России в условиях модернизации экономики»
Доклад на тему:«Финансовый бюджет России в условиях модернизации экономики» Тобольский гений Росси
Тобольский гений Росси Мультимедийный диск «Династия Озеровых и Рязанский край» Мультимедийный диск посвящен знаменитой рязанской династии. Представит
Мультимедийный диск «Династия Озеровых и Рязанский край» Мультимедийный диск посвящен знаменитой рязанской династии. Представит Иванов Игорь Петрович (1925-1991г)
Иванов Игорь Петрович (1925-1991г) George Washington
George Washington Планеты Солнечной системы. Отчего на Земле сменяются день и ночь, времена года
Планеты Солнечной системы. Отчего на Земле сменяются день и ночь, времена года Логические задания!
Логические задания! Подростковый алкоголизм
Подростковый алкоголизм Острая сердечная недостаточность у детей
Острая сердечная недостаточность у детей СТАРИННЫЕ РУССКИЕ МЕРЫ
СТАРИННЫЕ РУССКИЕ МЕРЫ Презентация "Повесть о Шемякином суде" - скачать презентации по МХК
Презентация "Повесть о Шемякином суде" - скачать презентации по МХК Урок-открытие
Урок-открытие Межгрупповой конфликт
Межгрупповой конфликт Воспитание здорового образа жизни школьника средствами изобразительного искусства
Воспитание здорового образа жизни школьника средствами изобразительного искусства Презентация на тему Основные формы рельефа суши
Презентация на тему Основные формы рельефа суши Электронный мониторинг«Наша новая школа»
Электронный мониторинг«Наша новая школа» Сказка для взрослых
Сказка для взрослых Healthy Meal Здоровая пища
Healthy Meal Здоровая пища Numbers
Numbers  Перспектива развития ЦО в свете нового законодательства
Перспектива развития ЦО в свете нового законодательства Управление в технических системах
Управление в технических системах Николай Хмеленок. Тренажёры по английскому языку. Расположите по порядку. Цвета
Николай Хмеленок. Тренажёры по английскому языку. Расположите по порядку. Цвета ДОКЛАД
ДОКЛАД ОТДЕЛ НОВОЙ ЭКОНОМИКИ
ОТДЕЛ НОВОЙ ЭКОНОМИКИ Адаптивная физическая культура
Адаптивная физическая культура