Содержание
- 2. ЦЕЛИ УРОКА: ЗАКРЕПИТЬ И УГЛУБИТЬ ЗНАНИЯ О СУЩНОСТИ ОВР; ПОЗНАКОМИТЬСЯ С МЕТОДОМ ПОЛУРЕАКЦИЙ И ЕГО ПРИМЕНЕНИЕМ
- 3. Продолжите… Окислительно-восстановительные реакции – это реакции……в ходе которых хотя бы один элемент изменил свою степень окисления
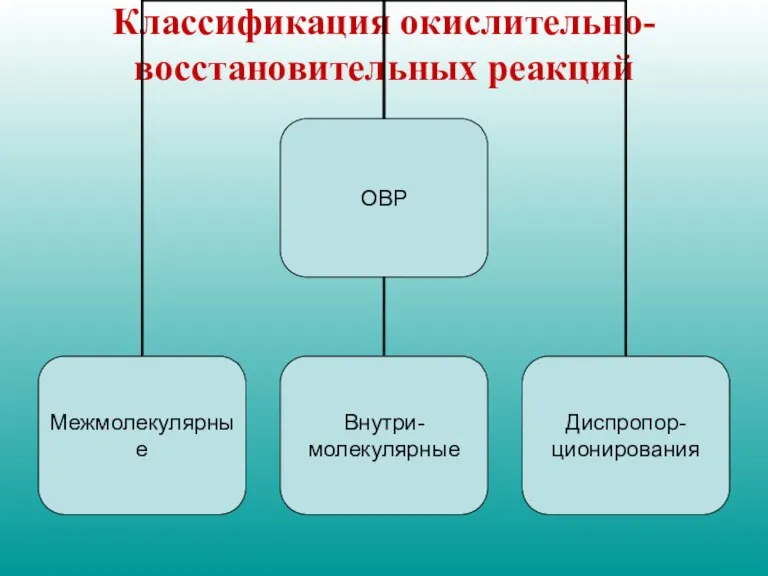
- 4. Классификация окислительно-восстановительных реакций
- 5. Выполните задание Допишите уравнения реакций, расставьте коэффициенты методом электронного баланса С6C5CH3 + KMnO4 + H2SO4 →
- 6. МЕТОДЫ СОСТАВЛЕНИЯ ОВР Метод электронного баланса Метод электронно - ионного баланса Метод Гарсиа Метод валентных связей
- 7. Основное требование Число электронов, отданных восстановителем = числу электронов, принятых окислителем
- 8. Электронно- ионный метод (МЕТОД ПОЛУРЕАКЦИЙ) Преимущество: при составлении полуреакций рассматриваются реально существующие в растворе ионы и
- 9. МЕТОД ПОЛУРЕАКЦИЙ: Алгоритм 1. Записать в ионном виде восстановитель, окислитель и продукты их взаимодействия: Сильные электролиты
- 10. II. При составлении полуреакций окисления и восстановления следует учитывать следующее: 1. Если исходное вещество содержит больше
- 11. алгоритм 2. Если исходное вещество содержит меньше атомов кислорода, чем продукты реакции, то недостаток их восполняется
- 12. Алгоритм расстановки коэффициентов методом полуреакций Запишите схему реакции в молекулярной форме: KMnO4 + Na2SO3 + H2SO4→
- 13. 2. Составьте схему реакции в полной ионной форме, подчеркнув восстановитель и окислитель K+ + MnO4- +
- 14. 3. Составьте сокращенную молекулярно-ионную схему MnO4- + SO32- + 2 H+ + SO42-→Mn 2+ + SO42-
- 15. 4. Определите характер среды – кислая, щелочная, нейтральная Наличие Н+ – среда кислая
- 16. 5. Выписать частицы, изменившие состав и заряд: MnO4- → Mn 2+ SO32- → SO42-
- 17. 6. Составьте молекулярно-ионные уравнения для процессов окисления и восстановления с учетом характера среды Проверьте число атомов
- 18. Проверьте суммы зарядов ионов в левой и правой частях молекулярно-ионных уравнений: Если сумма зарядов исходных частиц
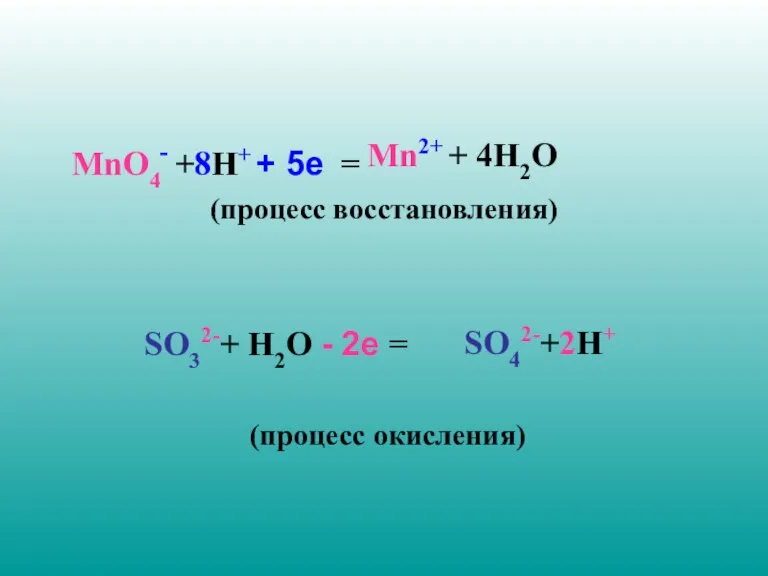
- 19. MnO4- +8H+ + 5е = (процесс восстановления) SO32-+ H2O - 2е = (процесс окисления) SO42-+2H+ Mn2+
- 20. 8. Найдите коэффициенты восстановителя, окислителя и продуктов их превращения. Умножьте левую и правую части обоих уравнений
- 21. Составьте сокращенное ионное уравнение окислительно-восстановительной реакции. Для этого: сложите уравнения полуреакций сократите, если имеются, одинаковые частицы
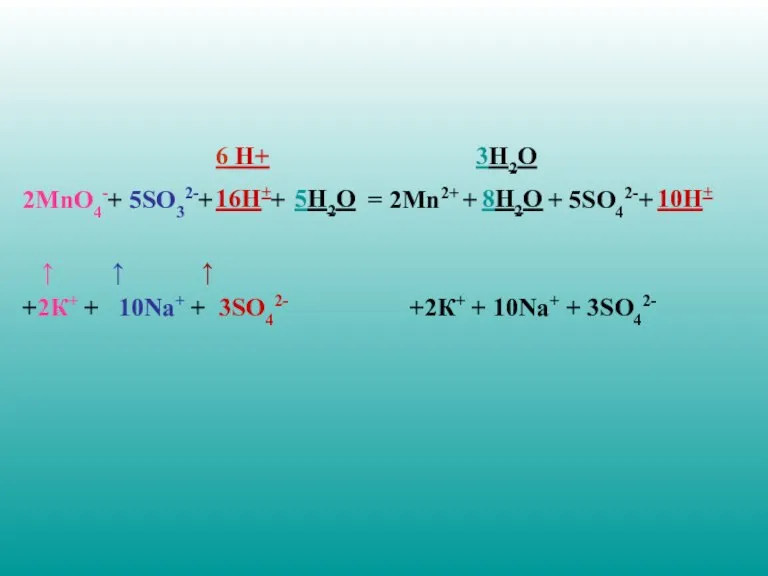
- 22. 2MnO4-+ 5SO32-+ + = 2Mn2+ + + 5SO42-+ ↑ ↑ ↑ +2К+ + 10Nа+ + 3SO42-
- 23. 10. Составьте полное молекулярно-ионное уравнение 2К+ +2MnO4-+ 10Nа+ + 5SO32-+6H+ + 3SO42- = = 2Mn2++ 2К+
- 25. Скачать презентацию



















 Линия, прямая в пространстве
Линия, прямая в пространстве  Велика Россия. Но нет в ней Александра Блока
Велика Россия. Но нет в ней Александра Блока Как оценить работу в Интернете? Юлия Рачинская Марина Курвитс
Как оценить работу в Интернете? Юлия Рачинская Марина Курвитс Культура речи педагога
Культура речи педагога Презентация на тему Ребусы, загадки, упражнения и вопросы
Презентация на тему Ребусы, загадки, упражнения и вопросы Презентация на тему Невская битва
Презентация на тему Невская битва  VI ФЕСТИВАЛЬ "Детские дни в Петербурге"
VI ФЕСТИВАЛЬ "Детские дни в Петербурге" Event Management
Event Management Организация межведомственного и межрегионального взаимодействия в области охраны лесов от пожаров
Организация межведомственного и межрегионального взаимодействия в области охраны лесов от пожаров WhirlpoolКондиционеры 2011
WhirlpoolКондиционеры 2011 РЕСУРСНЫЙ ПОТЕНЦИАЛ ВОЛГОГРАДСКОЙ ОБЛАСТИ
РЕСУРСНЫЙ ПОТЕНЦИАЛ ВОЛГОГРАДСКОЙ ОБЛАСТИ Занятие 7
Занятие 7 Центр образовательных услуг
Центр образовательных услуг Презентация на тему Древние германцы и Римская империя
Презентация на тему Древние германцы и Римская империя  Автокрановщик. Машинист крана (крановщик)
Автокрановщик. Машинист крана (крановщик) Как начиналась галерея
Как начиналась галерея О работе ШРР
О работе ШРР Морошка
Морошка Ярославская церковь Победа Христа
Ярославская церковь Победа Христа Географическое положение Северного Кавказа
Географическое положение Северного Кавказа Материально-техническое обеспечение бригады в бою
Материально-техническое обеспечение бригады в бою Цифровая фотография ее использование в рекламе
Цифровая фотография ее использование в рекламе Окислительно – восстановительные реакции 11 класс
Окислительно – восстановительные реакции 11 класс Девелоперская компания А+ Девелопмент
Девелоперская компания А+ Девелопмент Образность в дизайн-проектировании объектов окружающего мира. Дизайн-проект светильника Кошка
Образность в дизайн-проектировании объектов окружающего мира. Дизайн-проект светильника Кошка Полтавская битва 8 июля 1709 года
Полтавская битва 8 июля 1709 года Побудильник. Планирование ведет к высвобождению времени
Побудильник. Планирование ведет к высвобождению времени Мемы в промышленности
Мемы в промышленности