Слайд 2Определение.
Многоатомными спиртами называют вещества, которые являются производными углеводородов в которых два

или более атомов водорода замещены на гидрооксогруппы.
R-(OH)n где n>2
Слайд 3Физические свойства
CH2-OH этиленгликоль (Р.Н.)
|
CH2-OH этандиол (М.Н.)
Хорошо растворимая, вязкая жидкость, сладкая на вкус,
тем. кип.

197 градусов.
Слайд 4Способы получения.
1) CH2-Cl CH2-OH
| + 2 NaOH → | + 2NaCl
CH2-Cl CH2-OH
2)
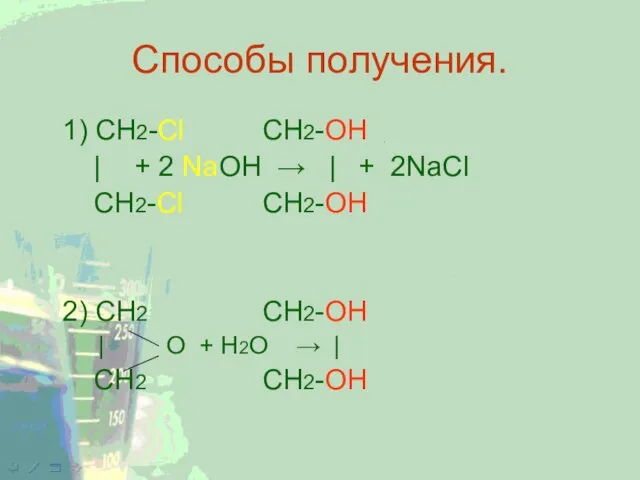
CH2 CH2-OH
| O + H2O → |
CH2 CH2-OH
Слайд 5Способы получения.
KMnO4 CH2-OH
3) СН2=СН2 + [O] + H2O → |
CH2-OH
Используется в
![Способы получения. KMnO4 CH2-OH 3) СН2=СН2 + [O] + H2O → |](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362219/slide-4.jpg)
качестве антифризов (тем. зам. до –40), исходного сырья для получения растворителей при получении ацетатного шелка, лавсана и др. веществ.
Слайд 6Химические свойства
1) CH2-ОН CH2-ONa
| + 2 Na → | + Н2
CH2-ОН CH2-ONa
Образуется: этиленгликолят
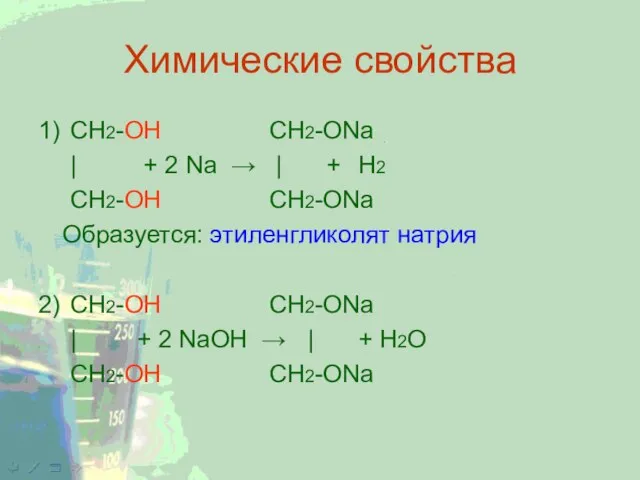
натрия
2) CH2-ОН CH2-ONa
| + 2 NaОН → | + Н2О
CH2-ОН CH2-ONa
Слайд 7Химические свойства
3) CH2-ОН HO-CH2 CH2-O-CH2
| + | → | |+ 2Н2О
CH2-ОН HO-CH2 CH2-О-CH2
Автор этой реакции Фаворский,
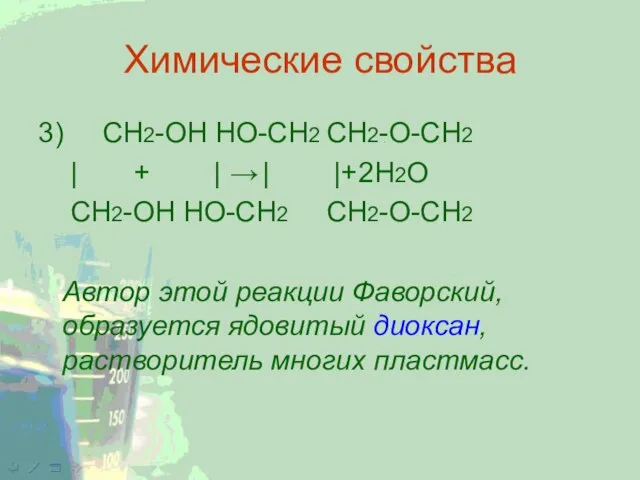
образуется ядовитый диоксан, растворитель многих пластмасс.
Слайд 8Химические свойства
4) CH2-ОН (к)H2SO4 CH2-O-NO2
| + 2 HNО3 → | + 2Н2О
CH2-ОН CH2-O-NO2
В присутствии концентрированной

серной кислоты, которая обладает водоотнимающим свойством, образуется ценное взрывчатое вещество – динитроэтиленгликоль.
Слайд 9Химические свойства
5) CH2-ОН CH2-OH H-C=O
| + [O] KMnO4 → |
![Химические свойства 5) CH2-ОН CH2-OH H-C=O | + [O] KMnO4 → |](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362219/slide-8.jpg)
+[O] KMnO4 → |
CH2-ОН -H2O CH-OH -H2O H-C=O |
OH
Образуется вещество - глиоксаль, которое используется как ускоритель вулканизации резины.
Слайд 10Химические свойства
6) CH2-ОН НО CH2-O
| + Cu → | Cu +
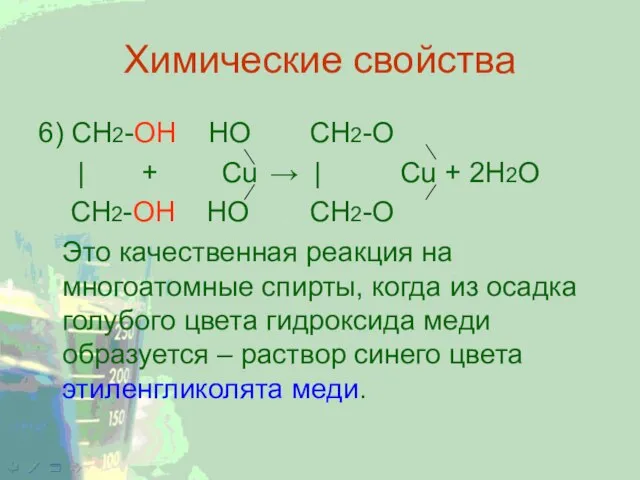
2Н2О
CH2-ОН НО CH2-O
Это качественная реакция на многоатомные спирты, когда из осадка голубого цвета гидроксида меди образуется – раствор синего цвета этиленгликолята меди.
Слайд 11Химические свойства
CH2-ОН
|
CH2-ОН
водородные связи расшатывают связь между водородом

и кислородом при этом появляется большая подвижность атомов водорода.
Слайд 12Глицерин.
Глицерин был открыт французским учёным - Шееле в 1779 г.
Густая жидкость,

хорошо растворимая в воде, сладкая на вкус, плотность 1,265 г\см3, тем.кип. 290. Получают синтетическим путем или при разложении жиров.
Слайд 13Химические свойства
CH2-ОН НО CH2-O
| Cu | Cu
CH-ОН + НО → CH -O + 2Н2О
| |
СН2-ОН СН2-ОН
Образуется раствор
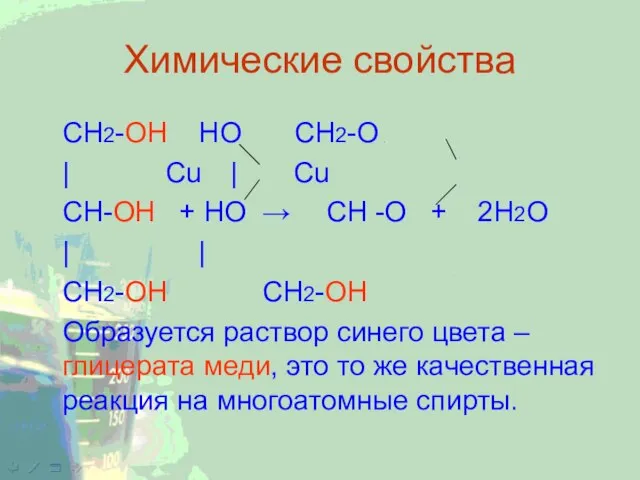
синего цвета – глицерата меди, это то же качественная реакция на многоатомные спирты.
Слайд 14Химические свойства
Реакция А. Нобеля
2) CH2-ОН CH2-O-NO2
| (к) H2SO4 |
CH-ОН +
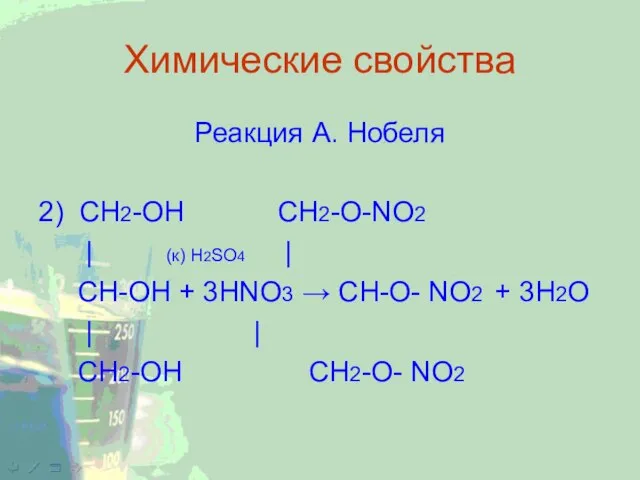
3НNO3 → CH-O- NO2 + 3Н2О
| |
СН2-ОН СН2-О- NO2
Слайд 15Химические свойства
Образуется тринитроглицерин, ценное взрывчатое вещество, которое в чистом виде не используется

из-за высокой бризантности, а в виде динамита или бездымного пороха, впервые его получил шведский ученый Нобель, так же используется в медицине как сердечное лекарство.
4 C3H5(ONO2)3 → 12 CO2 + 10 H2O + 6 N2 + O2
Слайд 16Химические свойства
3) CH2-ОН CH2
| (к)H2SO4 ||
CH-ОН → CH + 2 H2O
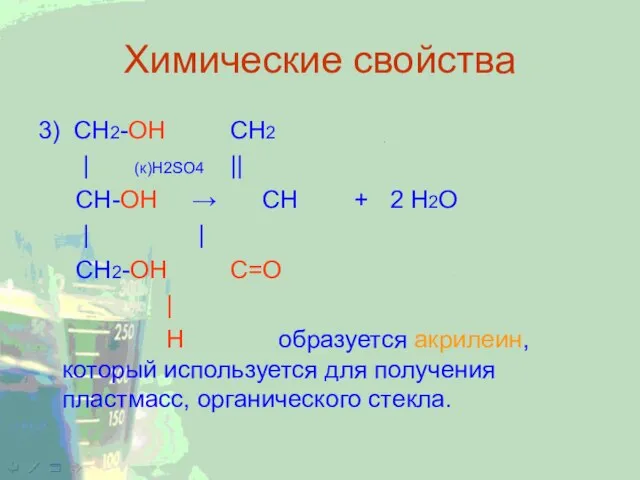
| |
СН2-ОН С=О
|
Н образуется акрилеин, который используется для получения пластмасс, органического стекла.
Слайд 17Физические свойства
ОН
| Карболовая кислота, бесцветные
| кристаллы, при слабом окислении

– розовые, плохо растворимые в воде (6,3 г. В 100 г. воды), при темп.70 градусов растворяются почти полностью.
Получают из каменноугольной смолы
Слайд 18Химические свойства
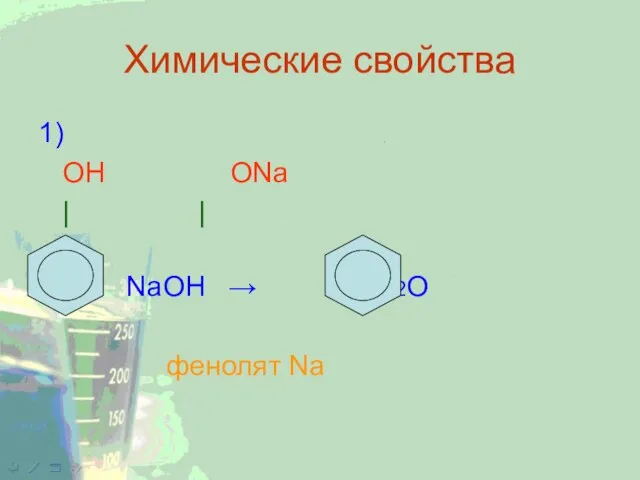
1)
ОН ОNa
| |
+ NaOH → + H2O
фенолят Na
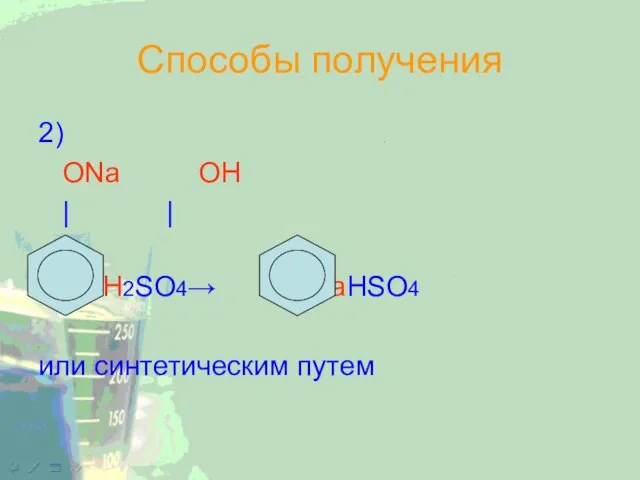
Слайд 19Способы получения
2)
ОNa ОН
| |
+ H2SO4→ + NaHSO4
или синтетическим путем
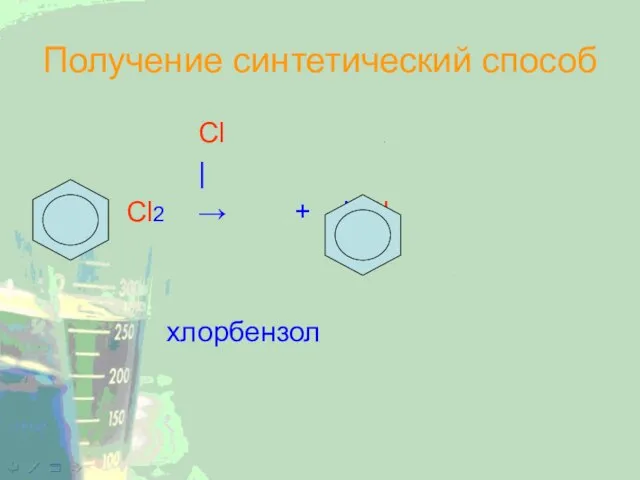
Слайд 20Получение синтетический способ
Cl
|
+ Cl2 → + HCl
хлорбензол
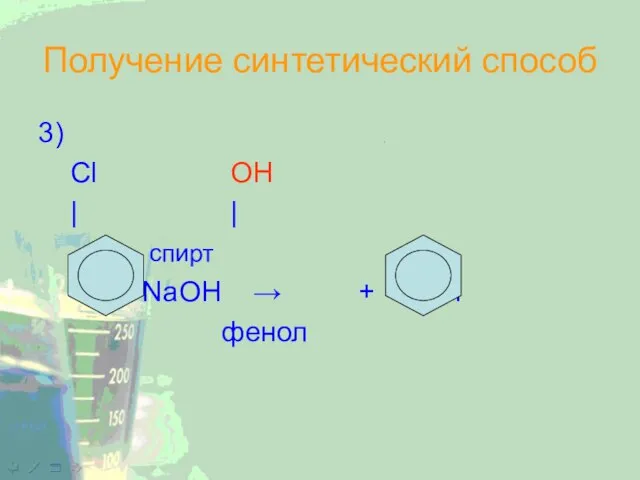
Слайд 21Получение синтетический способ
3)
Cl OH
| |
спирт
+ NaOH → + NaCl
фенол
Слайд 22Взаимное влияние атомов в феноле
4)
OH OH
↓ |
+q +q + 3Br2 → Br-
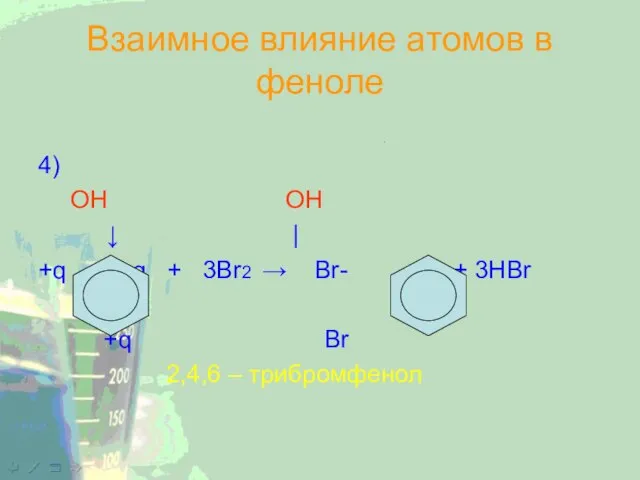
- Br + 3HBr
+q Br
2,4,6 – трибромфенол
Слайд 23Химические свойства
5) C6H5-ONa + Cl-C6H5 → C6H5 -0- C6H5
дифениловый эфир
6) 2 C6H5-OH +
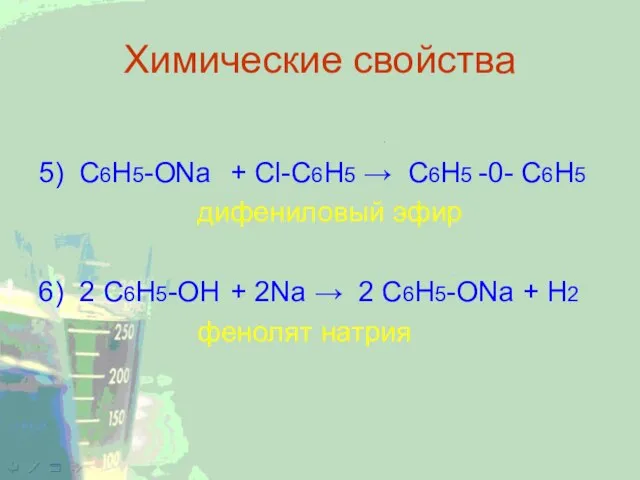
2Na → 2 C6H5-ONa + H2
фенолят натрия
Слайд 24Химические свойства
7) качественная реакция на фенол
3 C6H5-OH + FeCl3 →(C6H5-O-)3Fe + 3 HCl
фенолят
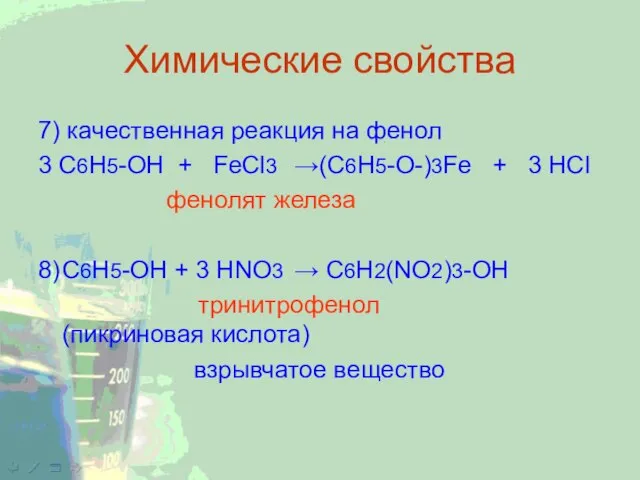
железа
8) C6H5-OH + 3 HNO3 → C6H2(NO2)3-OH
тринитрофенол (пикриновая кислота)
взрывчатое вещество
Слайд 25Химические свойства
9) фенол слабая кислота, поэтому угольная кислота вытесняет из растворов её

солей.
C6H5-ONa + CO2 + H2O → C6H5-OH +NaHCO3



![Способы получения. KMnO4 CH2-OH 3) СН2=СН2 + [O] + H2O → |](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362219/slide-4.jpg)



![Химические свойства 5) CH2-ОН CH2-OH H-C=O | + [O] KMnO4 → |](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362219/slide-8.jpg)
















 Отдельные виды договорных отношений в жилищном праве
Отдельные виды договорных отношений в жилищном праве Организация велостоянки для гимназии №1
Организация велостоянки для гимназии №1 О компании Основным направлением деятельности группы компаний InstaForex является предоставление услуг online-трейдинга клиентам с 2007 го
О компании Основным направлением деятельности группы компаний InstaForex является предоставление услуг online-трейдинга клиентам с 2007 го Урок русского языка в 6 классе по теме: «Правописание сложных существительных»
Урок русского языка в 6 классе по теме: «Правописание сложных существительных» Ярмарка инноваций в образовании Секция: Инновации в дошкольном образовании
Ярмарка инноваций в образовании Секция: Инновации в дошкольном образовании Невидимые нити в весеннем лесу (2 класс)
Невидимые нити в весеннем лесу (2 класс) Игрушки из носочков своими руками №7
Игрушки из носочков своими руками №7 Введение в специальность
Введение в специальность Герцог Ами
Герцог Ами Трение. Вредно или полезно
Трение. Вредно или полезно Правовой статус личности. Гражданство РФ
Правовой статус личности. Гражданство РФ Социальная психология
Социальная психология Презентация на тему АФАНАСИЙ НИКИТИН
Презентация на тему АФАНАСИЙ НИКИТИН  Теория обучения
Теория обучения Презентация на тему Our Environment (Наша окружающая среда)
Презентация на тему Our Environment (Наша окружающая среда) Универсальный программный комплекс для информационно-аналитического сопровождения (УПК ИАС)
Универсальный программный комплекс для информационно-аналитического сопровождения (УПК ИАС) Презентация по информатике на тему: «Устройства вывода информации, монитор.»
Презентация по информатике на тему: «Устройства вывода информации, монитор.» Круглопольское сельское поселение
Круглопольское сельское поселение Прайс косметологических услуг салона Забота о вас
Прайс косметологических услуг салона Забота о вас Патрон грязеуловителя
Патрон грязеуловителя Назначение изделия и его описание
Назначение изделия и его описание Планирование и организация процесса закупок материальных ресурсов промышленного предприятия
Планирование и организация процесса закупок материальных ресурсов промышленного предприятия Распространение объектно-ориентированного подхода на информационную безопасность
Распространение объектно-ориентированного подхода на информационную безопасность Определите тему произведения по моделям Дмитрий Наркисович Мамин - Сибиряк.
Определите тему произведения по моделям Дмитрий Наркисович Мамин - Сибиряк. Пейзаж в графике
Пейзаж в графике Рогожка. Коллекция однотонных штор
Рогожка. Коллекция однотонных штор _Презентация. Предоставление
_Презентация. Предоставление Презентация
Презентация