Слайд 2Цель урока:
Цель урока: Обобщение знаний о строении атома, изотопах, формирование понятия

«химический элемент», закрепление знаний о структуре Периодической Системы и изменении свойств элементов в периодах и группах.
Слайд 3Учебный Элемент – 1.
РАЗМИНКА «Знаки химических элементов»
Задание 1. (работаем вместе)
-

Под диктовку учителя запишите в строчку знаки химических элементов
Задание 2. (индивидуальная работа)
Выполняем задание по карточке
Слайд 4Карточка
Задание:
Выявите соответствие сведений в 1, 2 и 3 столбцах;
Допишите недостающие цифры.

Например: 1 - 9 – 5
Слайд 5Учебный Элемент – 2.
Строение атома
Задание 1 Ответьте на вопросы учителя

и заполните таблицу:
Вопросы:
Что такое элементарные частицы атома?
Что называется протоном, нейтроном, электроном?
Что такое нуклоны?
Чему равен заряд протона, нейтрона, электрона?
Как обозначают протоны, нейтроны, электроны?
Где находятся эти частицы в атоме?
Слайд 6Заполните таблицу: «Элементарные частицы атома»

Слайд 7Задание 2. Выполните тест.
В ядре атома алюминия протонов …
а) 26;

б) 13; в) 27.
Масса атома алюминия …
а) 26; б) 13; в) 27.
Электронов в атоме алюминия …
а) 26; б) 13; в) 14.
Нейтронов в атоме алюминия …
а) 27; б) 13; в) 14.
Энергетических уровней в атоме алюминия …
а) три; б) два; в) четыре.
Слайд 8Учебный Элемент – 3. Изотопы Относительная атомная масса.
1.Что общего в строении этих

атомов?
2.Чем данные атомы отличаются друг от друга?
3.Атомы одного или разных химических элементов
показаны на рисунке?
4. Что такое изотопы?
Слайд 9Задание 2 (индивидуальная работа)
Найдите среди элементов изотопы 17 Э 14 Э 18

Э 7 Э 16 Э
8 6 8 3 8
Изотопы какого химического элемента даны?
Задание 3 (работа с таблицей, работаем все вместе)
По таблице найдите относительную атомную массу для следующих химических элементов: азот, сера, магний, углерод, алюминий, фосфор.
Слайд 10Задание 4 Заполнить пропуски
Изотопы имеют ______________ число протонов в ядре и

____________ число нейтронов, поэтому у них разная _____________;
Химический элемент – совокупность атомов с __________________ зарядом ядра, т.е. совокупность ______________;
Химические свойства изотопов одного и того же элемента________________, т.к. они имеют ______________ заряд ядра (число протонов), _________________ число электронов, в том числе и на _________________ уровне.
Слайд 11Проверяем 4 –е задание Выводы:
Изотопы имеют одинаковое число протонов в ядре и

разное число нейтронов, поэтому у них разная масса;
Химический элемент – совокупность атомов с одинаковым зарядом ядра, т.е совокупность изотопов;
Химические свойства изотопов одного и того же элемента одинаковые, т.к. они имеют один и тот же заряд ядра (число протонов), одинаковое число электронов, в том числе и на внешнем уровне.
Слайд 12Учебный элемент -4 «Строение электронных оболочек атомов»
Задание -1. (работаем вместе)
+ 13
+
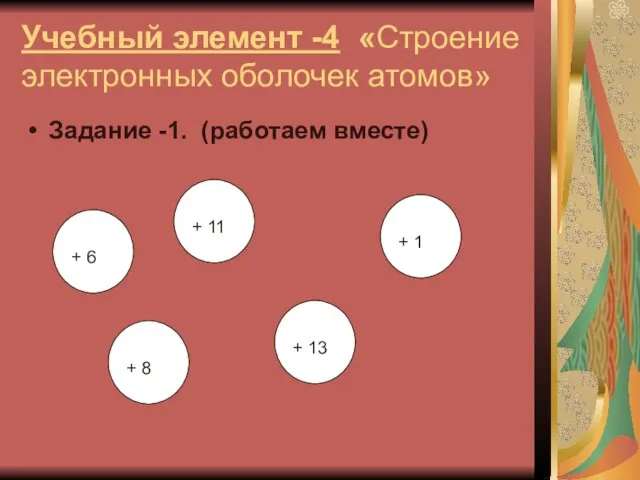
11
+ 1
+ 8
+ 6
Слайд 13Задание -2. (индивидуальная работа)
А) Выпишите схему, отражающую правильное расположение электронов в атоме

элементов:
2е, 8е, 18е
3е, 8е, 4е
2е, 9е 1е
2е, 8е, 3е
3е, 8е, 2е.
Б) Соотнесите название элемента и число электронов на внешнем уровне.
Элементы: 1) азот 2) углерод 3) магний
Число электронов на внешнем уровне:
А) 2 Б) 5 В) 4
Слайд 14Задание -3. (Работа по парам)
Опросите друг друга по вопросам: какие химические

элементы относятся к
металлам, 2)неметаллам, 3)благородным газам?
Запишите по 3 примера в таблицу (знаки химических элементов).
Проверьте друг друга.
Слайд 15Учебный Элемент – 5. Структура Периодической Системы.
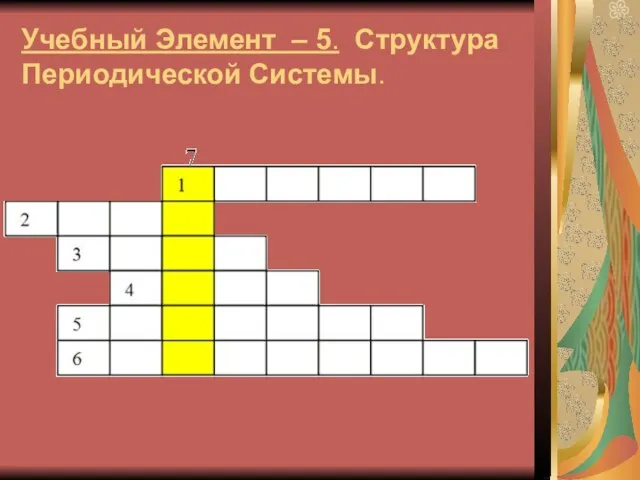
Слайд 16Вопросы кроссворда
1. Горизонтальный ряд элементов, расположенных в порядке возрастания заряда ядер

атомов.
2. Самый активный неметалл в периодической системе.
3. Элемент под № 10 в периодической системе.
4. Мельчайшая, химически неделимая частица.
5. Разновидности атомов одного химического элемента с одинаковыми зарядами ядер, но разной массой.
6. Ученый, создавший периодическую систему химических элементов.
7.------?
Слайд 17Тест 2.
1.Распределение электронов по энергетическим уровням для атома кремния :
1)2,8,2 2)2,8,4

3)2,8,3 4)2,8,5
2.В атоме алюминия число энергетических уровней равно:
1)2 2)3 3)4 4)1
3.Число энергетических уровней, по которым распределены электроны в атоме, равно
1)порядковому номеру элемента 2)номеру периода
3)номеру группы 4)заряду ядра
4Число полностью заполненных энергетических уровней в атоме кальция равно:
1)1 2)2 3)3 4)4
5. Элементу с атомным номером 17 соответствует электронная схема атома
1)2,7 2)2,8,3 3)2,8,7 4)2,8,8
6.Электронная схема 2,8,8,2 соответствует атому:
1)алюминия 2)магния 3)аргона 4)кальция
Слайд 18Учебный Элемент – 6.
Изменение свойств
Задание 1
Укажите знаком «→» ослабление металлических свойств

в следующих тройках элементов.
Na- Mg- Al Li- Na-K
Укажите знаком «→» усиление неметаллических свойств в следующих тройках элементов
S – P – Si F – Cl- Br
Слайд 19Задание 2 (индивидуальная работа)
Вставить пропущенные слова:
1.Сложная электронейтральная система, состоящая из протонов, нейтронов,

электронов называется …………
2.В пределах одной и той же группы П.С.(в главной подгруппе) сверху вниз ……………. свойства усиливаются.
3.В пределах одного и того же периода слева направо металлические свойства ………………, а неметаллические …………………..
4.Совокупность атомов с одинаковым зарядом ядра называется …………………………
5.В пределах одного и того же периода слева направо заряд ядра …………………, число электронов на внешнем уровне ……………………, радиус атома ……………….
Слова: (увеличивается, растет, атом , металлические, химический элемент, уменьшаются, не изменяется, усиливаются, ослабевают, уменьшается)


















 prezentatsia
prezentatsia Профессиональная сказка
Профессиональная сказка Электростатика
Электростатика Возможности использования отраслевых индексов РТС в анализе движений на рынке и построении инвестиционных стратегий
Возможности использования отраслевых индексов РТС в анализе движений на рынке и построении инвестиционных стратегий Платформы для мобильных приложений
Платформы для мобильных приложений Футбол. История, правила, техника и упражнения
Футбол. История, правила, техника и упражнения Разнообразие природы
Разнообразие природы о России на английском языке
о России на английском языке СТАНОВЛЕНИЕ И РАЗВИТИЕ МИКРОБИОЛОГИИ
СТАНОВЛЕНИЕ И РАЗВИТИЕ МИКРОБИОЛОГИИ Задачи
Задачи Информационная среда начальной школы как часть информационной культуры
Информационная среда начальной школы как часть информационной культуры Поклонимся великим тем годам. 9 мая
Поклонимся великим тем годам. 9 мая Logistics & Customs Introduction
Logistics & Customs Introduction Аттестационная работа. Дополнительная общеразвивающая программа для детей Золотой ключик
Аттестационная работа. Дополнительная общеразвивающая программа для детей Золотой ключик 20170212_my_pomnim
20170212_my_pomnim Лёгкая атлетика. Бег на средние дистанции
Лёгкая атлетика. Бег на средние дистанции Организационные структуры управления
Организационные структуры управления Как быть толерантным
Как быть толерантным Презентация на тему Походы Тимура (Тамерлана)
Презентация на тему Походы Тимура (Тамерлана)  Безударные гласные - презентация для начальной школы_
Безударные гласные - презентация для начальной школы_ Interrelation of cognitive areas
Interrelation of cognitive areas Устройство и принцип работы операционной системы Windows XP
Устройство и принцип работы операционной системы Windows XP Мужской и женский род
Мужской и женский род Тема: «Управление рисками»
Тема: «Управление рисками» Участие в работе по обеспечению и улучшению качества технологических процессов, систем управления, продукции и услуг
Участие в работе по обеспечению и улучшению качества технологических процессов, систем управления, продукции и услуг Неделя физики в нашей школе
Неделя физики в нашей школе Правительство национального единения
Правительство национального единения Жанровое своеобразие «Антоновских яблок» Ивана Бунина
Жанровое своеобразие «Антоновских яблок» Ивана Бунина