Содержание
- 2. Определение Мониторинг - деятельность, заключающаяся в контроле за ходом клинического исследования, обеспечении его проведения, сбора данных
- 3. Мониторирование может осуществляться сотрудник спонсора контрактно-исследовательская организация (Contract Research Organisation, CRO) независимый монитор
- 4. Цели мониторирования Убедиться что: права и благополучие субъектов защищены представленные данные являются точными, полными и подтверждаются
- 5. Виды визитов визит селекции исследовательского центра визит открытия центра плановый мониторинговый визит внеплановый мониторинговый визит ко-мониторинговый
- 6. Обязанности монитора проверить адекватность квалификации исследователей и достаточность имеющегося персонала для проведения исследований проверка соблюдения исследователем
- 7. Обязанности монитора проверить сроки годности и условия хранения препарата убедиться в том, что назначение препаратов сделано
- 8. Аудит клинических исследований
- 9. Контроль качества главный исследователь, исследовательская команда монитор центра (мониторинговый визит) спонсор / КИО (ко-мониторинговый визит) Data
- 10. Определение Аудит - комплексная и независимая проверка относящихся к исследованию деятельности и документации, проводимая для подтверждения
- 11. Цели и задачи аудита Убедиться что: обеспечивается безопасность и соблюдаются права субъектов исследования исследователь и персонал
- 12. Виды аудитов Внутренний – проводится сотрудниками отдела качества фармацевтической компании или КИО, которые непосредственно участвуют в
- 13. Аудит исследовательского центра Плановый – 10-25% центров Вне плановый (For Cause Audit) – критерии выбора: большое
- 14. Время проведения аудита Перед исследованием (обычно для фазы I) В период включения В период наблюдения за
- 15. Объекты проверки Случайно выбранные ИРК 100% информированные согласия 100% несовершеннолетних пациентов 100% серьезные нежелательные явления Регуляторные
- 16. Классификация находок аудита Значительное несоответствие правилам ICH GCP и существенные ошибки в данных исследования – (major
- 17. Инспекция клинических исследований
- 18. Определение Инспекция - действие уполномоченных органов, заключающееся в официальной проверке документации, оборудования, иных материалов, имеющих, по
- 19. Проводится Министерство здравоохранения и социального развития – для исследований, проводящихся на территории Российской Федерации Food and
- 20. Инспекция Министерства здравоохранения и социального развития Инспектируемый центр предупреждается о проверке в письменной форме Объекты проверки:
- 21. FDA инспекция Плановые - центры для проведения плановых инспекций выбираются наугад, когда нет подозрений в каких-либо
- 22. FDA инспекция Внеплановые – критерии выбора: Исследователь набрал запланированное количество пациентов для проведения клинического исследования «слишком
- 23. Объекты инспекции Роль каждого участника исследования, входящего в группу исследователя Степень делегирования полномочий от исследователя. Где
- 24. Классификация результатов NAI — no action indicated. Требования к проведению исследования соблюдены полностью; VAI — voluntary
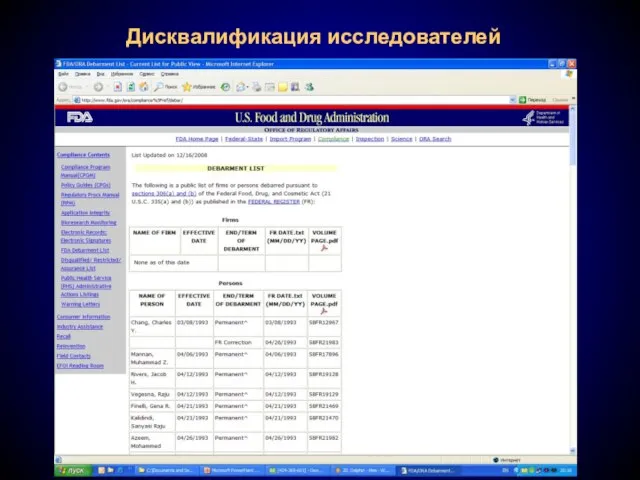
- 25. Дисквалификация исследователей В том случае, если в ходе инспекции будет выявлено, что исследователь неоднократно или намеренно
- 26. Дисквалификация исследователей
- 27. FDA инспекция В течение 15 дней в FDA должен быть послан ответ с планом корректирующих мероприятий
- 29. Скачать презентацию

























 Абузярова Луиза Ибрагимовна
Абузярова Луиза Ибрагимовна Teatro Colon
Teatro Colon Организация образовательной деятельности в условиях ФГОС для обучающихся с ОВЗ
Организация образовательной деятельности в условиях ФГОС для обучающихся с ОВЗ Прогресс-Гарант
Прогресс-Гарант Мы рады приветствовать вас в группе компаний ПИК
Мы рады приветствовать вас в группе компаний ПИК ВКР: Геодезические работы при строительстве СПГ Портовая
ВКР: Геодезические работы при строительстве СПГ Портовая Детское объединение Юность
Детское объединение Юность Правила дорожного движения для пешехода
Правила дорожного движения для пешехода Эмблема ООН
Эмблема ООН Природные сообщества
Природные сообщества Противодействие утечкам конфиденциальной информации и персональных данных
Противодействие утечкам конфиденциальной информации и персональных данных Мультиспонсорский проект «Междисциплинарный подход в терапии внутренних болезней»
Мультиспонсорский проект «Междисциплинарный подход в терапии внутренних болезней» Типы ВНД. Запольская М. Борзых Ю
Типы ВНД. Запольская М. Борзых Ю Работа выполнена в рамках проекта «Повышение квалификаций различных категорий работников образования и формирование у них базов
Работа выполнена в рамках проекта «Повышение квалификаций различных категорий работников образования и формирование у них базов Олимпиада школьников Ломоносов по психологии
Олимпиада школьников Ломоносов по психологии Презентация на тему Напряжение
Презентация на тему Напряжение Cтивен Р. Кови Принцип-центричное руководство
Cтивен Р. Кови Принцип-центричное руководство Russian presidential academy of the national economy and public admistration noth-west institute of management municipal
Russian presidential academy of the national economy and public admistration noth-west institute of management municipal Шагаа сүзүктери
Шагаа сүзүктери Класификация товаров
Класификация товаров Was machen wir in der Freizeit
Was machen wir in der Freizeit Основы теории конечных автоматов
Основы теории конечных автоматов Наука и полёт фантазии (анализ главы 12 из романа «Затерянный мир»)
Наука и полёт фантазии (анализ главы 12 из романа «Затерянный мир») Воображение и творчество
Воображение и творчество «Тропинка, кочки, копна»
«Тропинка, кочки, копна» Kochaj mnie
Kochaj mnie yfvhyt
yfvhyt Еда и напитки, не выходя из офиса
Еда и напитки, не выходя из офиса