Содержание
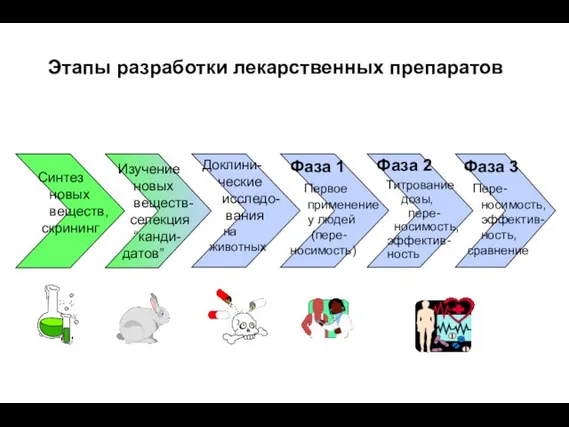
- 2. Фаза 3 Пере- носимость, эффектив- ность, сравнение Фаза 1 Первое применение у людей (пере-носимость) Фаза 2
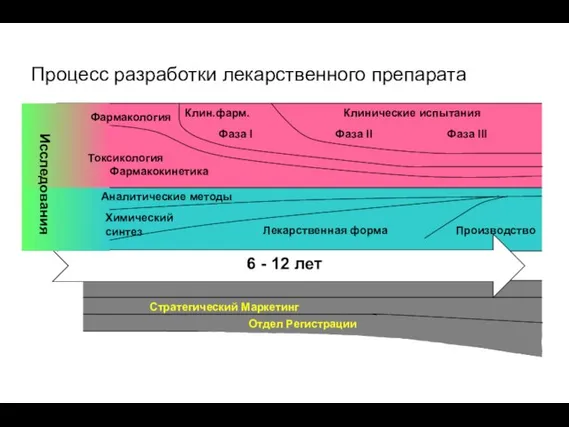
- 3. Процесс разработки лекарственного препарата Аналитические методы Лекарственная форма Производство Химический синтез
- 4. Зачем нужны клинические испытания Ряд заболеваний иначе протекает у животных В эксперименте невозможно оценить субъективные симптомы
- 5. Популяция Большая группа людей, проживающая в определенном географическом регионе например, популяция жителей Москвы или обладающих некоторым
- 6. Выборка Часть популяции, полученная путем отбора Выборка должна быть репрезентативна, т.е. отражать значимые признаки популяции, частью
- 7. Плацебо Лекарственная форма, неотличимая от исследуемого препарата по внешнему виду, цвету, вкусу и т.п., но не
- 8. Плацебо-эффект Изменение состояния пациента (отмечаемое сами пациентом или лечащим врачом), связанное с фактом лечения, а не
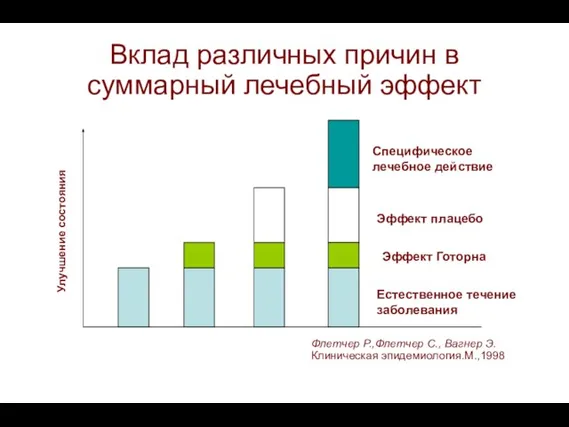
- 9. Вклад различных причин в суммарный лечебный эффект Естественное течение заболевания Эффект Готорна Эффект плацебо Специфическое лечебное
- 10. Рандомизация Распределение пациентов по группам случайным путём, благодаря чему достигается отсутствие различий между двумя сравниваемыми группами
- 11. Открытые и «слепые» исследования Слепой/маскированный метод - метод, при котором одной или более участвующим в клиническом
- 12. «Слепой» метод «Простой слепой метод» - у пациента отсутствует информация о том, какой препарат - исследуемый
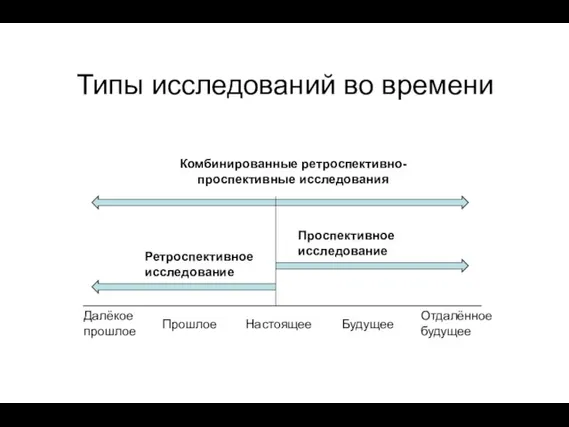
- 13. Типы исследований во времени Проспективное исследование Ретроспективное исследование Комбинированные ретроспективно-проспективные исследования Далёкое прошлое Настоящее Прошлое Будущее
- 14. Дизайн клинических испытаний Несравнительные исследования Сравнительные исследования параллельный (дизайн параллельных групп) перекрёстный дизайн последовательный соответствующих пар
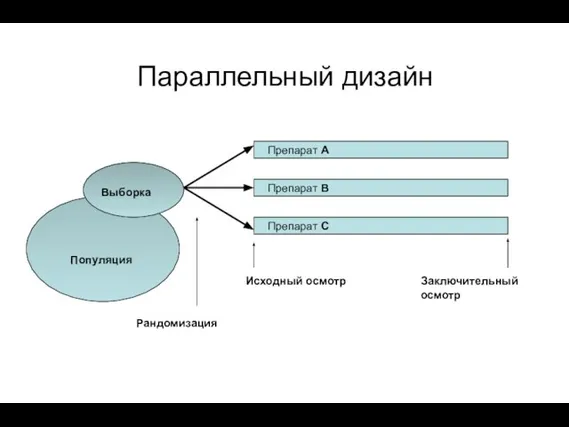
- 15. Параллельный дизайн Популяция Рандомизация Выборка Исходный осмотр Заключительный осмотр Препарат А Препарат В Препарат С
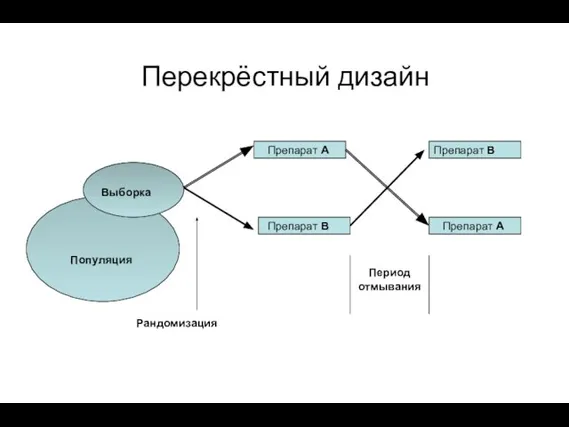
- 16. Перекрёстный дизайн Популяция Рандомизация Выборка Препарат А Препарат В Препарат В Препарат А Период отмывания
- 17. Типы клинических испытаний в зависимости от цели Фармакологические исследования у человека Установление терапевтической эффективности Подтверждение терапевтической
- 18. I фаза - фармакологические исследования Переносимость повышающихся доз Фармакокинетика и фармакодинамика при однократном введении при многократном
- 19. Исследования I фазы позволяют Установить переносимость Оценить/описать фармакокинетику и фармакодинамику Исследовать лекарственные взаимодействия Оценить активность препарата
- 20. II фаза - установление терапевтической эффективности Оценка эффективности, используя суррогатные, фармакологические маркёры или клинические измерения Исследования
- 21. Исследования II фазы позволяют Оценить применения для целевой популяции (больных) Оценить дозы для последующих исследований Обеспечить
- 22. III фаза - подтверждение терапевтической эффективности Контролируемые исследования эффективности и безопасности с истинными итоговыми маркёрами (смертность,
- 23. Исследования III фазы позволяют Продемонстрировать/подтвердить эффективность Установить профиль безопасности Адекватно оценить соотношение польза/риск Установить взаимосвязь доза-эффект
- 24. IV фаза - терапевтическое применение Сравнительные исследования эффективности, безопасности Исследования с истинными итоговыми маркёрами Исследования с
- 25. Исследования IV фазы позволяют Окончательно установить соотношение польза/риск для всей или специальной популяции Выявить редкие побочные
- 26. Постмаркетинговые наблюдательные исследования Анкеты, наблюдательные исследования, в отличие от контролируемых испытаний IV фазы, не являются в
- 27. Протокол испытания Документ, который описывает задачи, методологию, процедуры, статистические аспекты и организацию исследования. Правила проведения качественных
- 28. Основные элементы протокола (I) Элемент Цель исследования Значимость (исходные данные) План исследования Дизайн исследования Сроки Субъекты
- 29. Основные элементы протокола (II) Элемент Исследуемое лечение Исследуемый препарат Препарат(ы) сравнения Переменные интереса Статистические вопросы Гипотеза
- 30. Структура протокола Титульный лист Клинический раздел Организационно-административный раздел Этические и правовые вопросы Мониторинг исследования Регистрация данных
- 31. Многоцентровое клиническое испытание Клиническое испытание, проводимое по единому протоколу более чем в одном исследовательском центре и,
- 32. Good Clinical Practice (GCP) «Качественная клиническая практика» Стандарты, в соответствии с которыми планируются, проводятся клинические результаты
- 33. Мета-анализ Количественный анализ объединённых результатов нескольких клинических испытаний одного и того же вмешательства. Используется для обобщенного
- 34. Мета-анализ (II) Отдельные исследования должны быть сходны между собой по характеристикам пациентов, вмешательствам, показателям исходов. Мета-анализ
- 35. Ошибки в интерпретации результатов исследований Экстраполяция данных in vitro на человека Экстраполяция данных узкой выборки на
- 36. Ошибки в интерпретации результатов исследований (II) В малых исследованиях могут быть получены впечатляющие, но статистически не
- 37. БЕЗОПАСНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
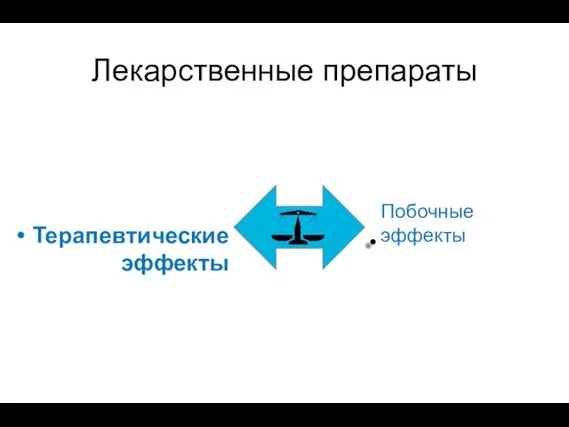
- 38. Лекарственные препараты Терапевтические эффекты Побочные эффекты
- 40. Данные о побочных эффектах Безопасность больного Предупреждения для врача Информация для пациента Информация для органов здравоохранения
- 41. Выявление побочных эффектов . D.Laurence, P.Bennet, Clinical Pharmacology
- 42. Частота сообщений число сообщений о ПЭ число пациентов, принимающих препарат =
- 43. Термины Нежелательные явления Побочные эффекты лекарств Серьезные нежелательные явления Непредвиденные побочные эфекты
- 44. Нежелательные явления Любые выявленные у пациента, получающего лекарственное средство, или субъекта клинического исследования, нежелательные симптомы (включая
- 45. Побочные эффекты лекарств Любая неблагоприятная реакция, связанная с применением лекарственного средства в дозах, обычно используемых для
- 46. Серьезные нежелательные явления Любые неблагоприятные клинические проявления, которые вне зависимости от дозы препарата - приводят к
- 47. Непредвиденный побочный эффект лекарства Нежелательная реакция, характер или тяжесть которой не согласуется с имеющейся информацией о
- 49. Скачать презентацию







































 Букеты. Состав и цены
Букеты. Состав и цены Этиология и патогенез
Этиология и патогенез Качество Lemförder и конкурентов
Качество Lemförder и конкурентов Памятка: по рабочему месту аппаратчика конденсации (Общие правила работы на компрессоре 3ГП)
Памятка: по рабочему месту аппаратчика конденсации (Общие правила работы на компрессоре 3ГП) Золотое сечение
Золотое сечение Права и обязанности граждан
Права и обязанности граждан Дизайн-проект по преобразованию столовой школы
Дизайн-проект по преобразованию столовой школы Эмоциональный интеллект
Эмоциональный интеллект Критерии готовности образовательного учреждения к введению федерального государственного образовательного стандарта (ФГОС НОО)
Критерии готовности образовательного учреждения к введению федерального государственного образовательного стандарта (ФГОС НОО) Лайнер Norwegian star. Июль 2018 г
Лайнер Norwegian star. Июль 2018 г Учителями славится Россия
Учителями славится Россия Смутное время в картинах художников (XVII век)
Смутное время в картинах художников (XVII век) Влияние ЕГЭна систему образования: доступность, эффективность, качество
Влияние ЕГЭна систему образования: доступность, эффективность, качество Кадетский 6 класс
Кадетский 6 класс Основы автоматического управления
Основы автоматического управления Презентация на темум Мусор и как с ним бороться
Презентация на темум Мусор и как с ним бороться Центр содействия трудоустройству выпускников Как правильно составить резюме Руководитель ЦСТВ ДГТУ Л.А.Сучкова
Центр содействия трудоустройству выпускников Как правильно составить резюме Руководитель ЦСТВ ДГТУ Л.А.Сучкова Процесс дисконтирования. Экономическая эффективность инвестиций
Процесс дисконтирования. Экономическая эффективность инвестиций PR-технологии: Война за кадры Евгения Дельнова, Директор подразделений Kelly Engineering & IT Resources
PR-технологии: Война за кадры Евгения Дельнова, Директор подразделений Kelly Engineering & IT Resources Салаты региональных кухонь мира
Салаты региональных кухонь мира Европейский культурный фонд: возможности для украинских культурных НГО
Европейский культурный фонд: возможности для украинских культурных НГО Интеграция исследовательской деятельности в образовательный процесс школы
Интеграция исследовательской деятельности в образовательный процесс школы Бассейн
Бассейн D
D Lektsii_po_znakovym_sistemam1-2
Lektsii_po_znakovym_sistemam1-2 Звуковые волны
Звуковые волны Отгадай персонажа из аниме 1
Отгадай персонажа из аниме 1 Презентация на тему Антропогенез. Стадии антропогенеза
Презентация на тему Антропогенез. Стадии антропогенеза