Содержание
- 2. Натрий тиосульфаты (антихлор, гипосульфит, натрий сульфидотриоксосульфаты) — бейорганикалық қосылыс, Na2S2O3 немесе Na2SO3S химиялық формуласы бар натрий
- 3. НАТРИЙ ТИОСУЛЬФАТЫНЫҢ ЖАЛПЫ ҚАСИЕТТЕРІ Сырт пішінімен – түссіз кристал. Кристалдық формасы – моноклинді. Натрий тиосульфаты ауада
- 4. Натрий тиосульфатын алғаш рет 1799 жылы Шоссье Натрий тиосульфатын күкіртпен натрий сульфитінің ерітіндісін қайнату арқылы алған:
- 5. АЛЫНУЫ: Na полисульфидтердің тотығуы; Артық күкіртті Na2SO3 -пен қайнату: Na2SO3 + S → Na2S2O3 H2S және
- 6. Таза сусыз натрий тиосульфатын формамидте натрий нитритімен күкірт реакциясы арқылы алуға болады. Бұл реакция теңдеу арқылы
- 7. Барлық химиялық реакцияларда гипосульфит күшті тотықсыздандырғыш ретінде көрінеді. Күшті тотықтырғыштармен әрекеттесу реакцияларында Na2S2O3 сульфатқа немесе күкірт
- 8. Тиосульфат қайнар көзі болып кейбір органикалық өндірістердің ағын сулары болып табылады. Тиокарбанилдің өндірісінің ағын суларының құрамында
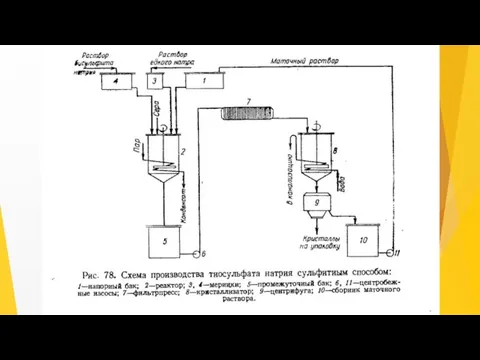
- 9. Натрий тиосульфатын алу процесі ( сурет. 22) күкірт диоксидінің сульфитті-содалы ерітіндімен сіңірілуін; күкірт қойыртпағын алуды; натрий
- 10. Натрий тиосульфатын сульфитті әдіспен өндіру технологиясы келесі негізгі кезеңдерден тұрады: натрий тиосульфатының түзілуі; 2) натрий тиосульфаты
- 12. Натрий тиосульфаты (Sodium thiosulfate) Түссіз мөлдір түйіршіктер немесе иіссіз кристалдар, дәмі ащы; суда өте оңай ериді
- 14. Скачать презентацию










 Материалы для дистанционной поддержки учащихся по дополнительной программе Шахматы для начинающих
Материалы для дистанционной поддержки учащихся по дополнительной программе Шахматы для начинающих Основы построения телекоммуникационных систем и сетей Лекция №7 «Сеть следующего поколения» профессор Соколов Н.А.
Основы построения телекоммуникационных систем и сетей Лекция №7 «Сеть следующего поколения» профессор Соколов Н.А. 16 ноября 2007 г. Николай Димченко Управляющий директор Долговое агентство «Пристав» Управление проблемными активами – современный
16 ноября 2007 г. Николай Димченко Управляющий директор Долговое агентство «Пристав» Управление проблемными активами – современный  Компьютер в жизни подростка
Компьютер в жизни подростка АНАЛИЗ РАБОТЫ ШКОЛЫ ЗА 2010-2011 УЧЕБНЫЙ ГОД
АНАЛИЗ РАБОТЫ ШКОЛЫ ЗА 2010-2011 УЧЕБНЫЙ ГОД Презентация на тему: Помоги ёжику
Презентация на тему: Помоги ёжику Изготовление платья. Внесение изменений .Обработка рюш, настрачивание рюш на полочки
Изготовление платья. Внесение изменений .Обработка рюш, настрачивание рюш на полочки Новеллы в законодательстве о контрактной системе в сфере закупок товаров, работ и услуг для государственных нужд
Новеллы в законодательстве о контрактной системе в сфере закупок товаров, работ и услуг для государственных нужд Сила трения. Трения в природе и технике
Сила трения. Трения в природе и технике Прошу дождя
Прошу дождя Формы организации внеурочной деятельности в условиях введения ФГОС НОО
Формы организации внеурочной деятельности в условиях введения ФГОС НОО Цветы
Цветы Взаимодействие HR и руководителей производственных подразделений
Взаимодействие HR и руководителей производственных подразделений Библиотека
Библиотека конфигурация по расчету квартплаты в Украине
конфигурация по расчету квартплаты в Украине Республика Казахстан Министерство образования и науки РК Внедрение фостерной заботы:опыт, извлеченные уроки
Республика Казахстан Министерство образования и науки РК Внедрение фостерной заботы:опыт, извлеченные уроки Рецидивная преступность
Рецидивная преступность Слитное и раздельное написание НЕ с наречиями на - О и -Е
Слитное и раздельное написание НЕ с наречиями на - О и -Е Песколовки
Песколовки Общая фармакология
Общая фармакология  Теоретические основы маркетинга
Теоретические основы маркетинга Новый уровень энергосбережения, безопасности и комфорта
Новый уровень энергосбережения, безопасности и комфорта Администрация городского округа Самара Автономное муниципальное образовательное учреждение высшего профессионального образова
Администрация городского округа Самара Автономное муниципальное образовательное учреждение высшего профессионального образова Влияние внутренней обратной связи на свойства резонансного усилителя
Влияние внутренней обратной связи на свойства резонансного усилителя Лекция №1Становление и развитие компьютерных систем автоматизации
Лекция №1Становление и развитие компьютерных систем автоматизации «Международное сотрудничество в сфере уголовного судопроизводства »
«Международное сотрудничество в сфере уголовного судопроизводства » Итальянский стиль в интерьере
Итальянский стиль в интерьере Воспитателя детского сада
Воспитателя детского сада