Содержание
- 2. 1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди.
- 3. 1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди.
- 4. Расположить в порядке увеличения силы электролита: HF K=7.10-4 HCN K=8.10-10 HNO2 K=5,1.10-4 NH4OH K=2.10-5
- 5. Расположить в порядке увеличения кислотных свойств: H2O HCl H2 SO3 NH3
- 6. Расположить в порядке увеличения основных свойств: NH3 C6H5-NH2 C6H5-NH-C6H5 CH3-NH2
- 7. Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2.
- 8. Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2.
- 10. Скачать презентацию
Слайд 21. Катион – это:
а) ион меди; б) атом серы; в) ион серы;
1. Катион – это: а) ион меди; б) атом серы; в) ион серы;

г) атом меди.
2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода.
3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой: а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфат-ионы: а) Na2S; б) SO3; в) Na2SO4; г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода: а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода.
3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой: а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфат-ионы: а) Na2S; б) SO3; в) Na2SO4; г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода: а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
Выберите правильные ответы:
Слайд 31. Катион – это:
а) ион меди; б) атом серы; в) ион серы;
1. Катион – это: а) ион меди; б) атом серы; в) ион серы;

г) атом меди.
2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода.
3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой: а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфат-ионы: а) Na2S; б) SO3; в) Na2SO4; г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода: а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода.
3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой: а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфат-ионы: а) Na2S; б) SO3; в) Na2SO4; г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода: а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
Выберите правильные ответы:
Слайд 4Расположить в порядке увеличения силы электролита:
HF K=7.10-4
HCN K=8.10-10
HNO2 K=5,1.10-4
NH4OH K=2.10-5
Расположить в порядке увеличения силы электролита:
HF K=7.10-4
HCN K=8.10-10
HNO2 K=5,1.10-4
NH4OH K=2.10-5
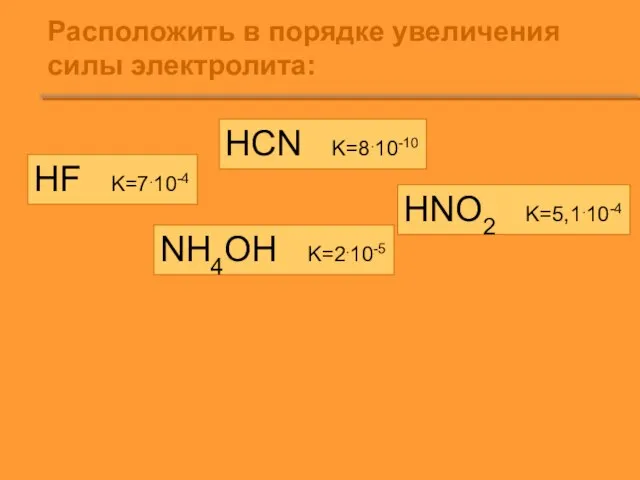
Слайд 5Расположить в порядке увеличения кислотных свойств:
H2O
HCl
H2 SO3
NH3
Расположить в порядке увеличения кислотных свойств:
H2O
HCl
H2 SO3
NH3
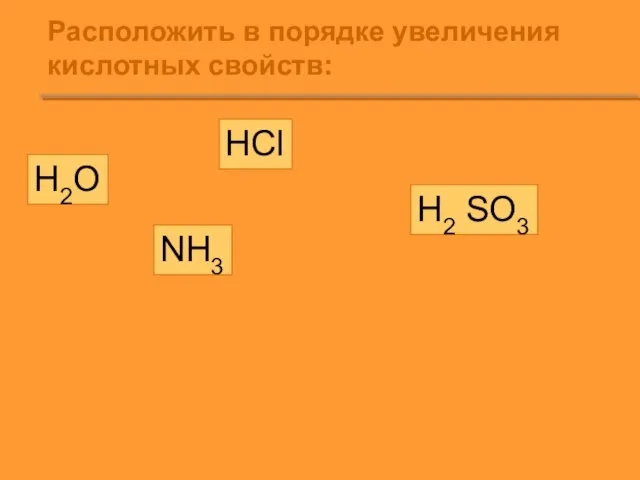
Слайд 6Расположить в порядке увеличения основных свойств:
NH3
C6H5-NH2
C6H5-NH-C6H5
CH3-NH2
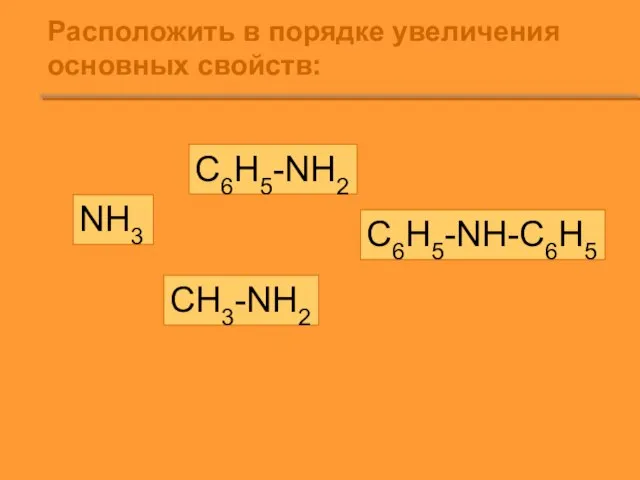
Расположить в порядке увеличения основных свойств:
NH3
C6H5-NH2
C6H5-NH-C6H5
CH3-NH2
Слайд 7Укажи, допущены ли ошибки в тексте:
1. На процесс диссоциации влияет растворение или
Укажи, допущены ли ошибки в тексте:
1. На процесс диссоциации влияет растворение или

расплавление вещества.
2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом не всегда совпадает с числом атомов водорода в ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации вещества по первой ступени всегда больше, чем по второй.
6. Степень диссоциации зависит от температуры и концентрации электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.
2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом не всегда совпадает с числом атомов водорода в ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации вещества по первой ступени всегда больше, чем по второй.
6. Степень диссоциации зависит от температуры и концентрации электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.
Слайд 8Укажи, допущены ли ошибки в тексте:
1. На процесс диссоциации влияет растворение или
Укажи, допущены ли ошибки в тексте:
1. На процесс диссоциации влияет растворение или

расплавление вещества.
2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом атомов водорода в ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации слабой кислоты по первой ступени всегда больше, чем по второй.
6. Степень диссоциации зависит от температуры и концентрации электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.
2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом атомов водорода в ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации слабой кислоты по первой ступени всегда больше, чем по второй.
6. Степень диссоциации зависит от температуры и концентрации электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.
- Предыдущая
Hotpoint|Ariston FS ЛегеднаСледующая -
Плавание судов Евразия 4 класс
Евразия 4 класс Город будущего
Город будущего Рождество, да святки – ряженье, колядки.
Рождество, да святки – ряженье, колядки. Единая информационная база домашних животных и животных без владельцев
Единая информационная база домашних животных и животных без владельцев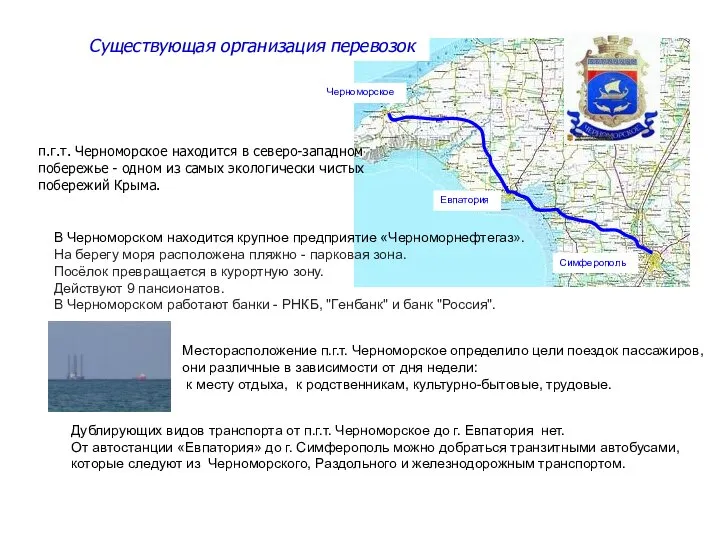 Существующая организация перевозок п.г.т. Черноморское
Существующая организация перевозок п.г.т. Черноморское Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс)
Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс) Классный час на тему:
Классный час на тему: Презентация на тему наклонения глагола
Презентация на тему наклонения глагола  404_A_N_D
404_A_N_D Сертификация СЭД на соответствие Закону «О персональных данных» Алексей Сидак, Центр безопасности информации Андрей Гриб, компан
Сертификация СЭД на соответствие Закону «О персональных данных» Алексей Сидак, Центр безопасности информации Андрей Гриб, компан Пейзаж
Пейзаж Анонимная сеть TOR
Анонимная сеть TOR Комплексный подход к работе с конверсией с помощью эконометрического моделирования
Комплексный подход к работе с конверсией с помощью эконометрического моделирования Хозяйство Руси и положение различных групп общества в XIV-XV вв
Хозяйство Руси и положение различных групп общества в XIV-XV вв Историческая школа в русской фольклористике
Историческая школа в русской фольклористике Осінні настрої
Осінні настрої Институт наук о Земле 2022
Институт наук о Земле 2022 Анализ финансового состояния в филиале ООО Авангард Цивильский бекон
Анализ финансового состояния в филиале ООО Авангард Цивильский бекон 9 класс МОУ «Сутчевская СОШ»
9 класс МОУ «Сутчевская СОШ» «СЕВЕРСТАЛЬ-УКРАИНА» — НАМ 5 ЛЕТ!
«СЕВЕРСТАЛЬ-УКРАИНА» — НАМ 5 ЛЕТ! Самоуправление
Самоуправление Презентация на классный час на тему_ Россия-страна возможностей_
Презентация на классный час на тему_ Россия-страна возможностей_ Электронный учебник Биография и педагогическое наследие Петра Францевича Лесгафта
Электронный учебник Биография и педагогическое наследие Петра Францевича Лесгафта Богатырский напиток, что силу и бодрость дает
Богатырский напиток, что силу и бодрость дает СХЕМА САЙТА
СХЕМА САЙТА Токарь
Токарь Герои, борцы, защитники. Изобразительное искусство
Герои, борцы, защитники. Изобразительное искусство Волшебный сундучок
Волшебный сундучок