Содержание
- 2. Направления деятельности регуляторных органов В большинстве развитых стран Европы, в США и Японии основными направлениями деятельности
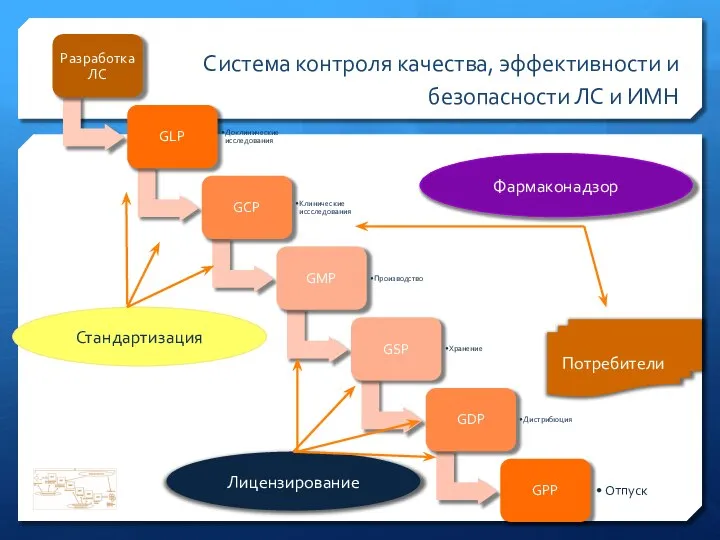
- 3. Система контроля качества, эффективности и безопасности ЛС и ИМН Фармаконадзор Лицензирование Стандартизация Потребители
- 4. МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ В СФЕРЕ ЗДРАВООХРАНЕНИЯ ПИСЬМО от 6 августа 2015
- 5. Нарушения отпуск без рецептов препаратов рецептурного отпуска, предложение дорогостоящих препаратов при наличии более дешевых, отказ в
- 6. Об основах охраны здоровья граждан в Российской Федерации Федеральный закон РФ от 21.11.2011 № 323-ФЗ О
- 7. Федеральные законы в которых изложены цели и принципы стандартизации в РФ, от 04.05.11г. № 99-ФЗ «О
- 8. Постановления Правительства РФ от 22.12.2011 № 1081 «О лицензировании фармацевтической деятельности», Приказ Минздрава России от 26.10.2015
- 9. Приказы от 22.11.2004 г. №205 «Об утверждении Положения о территориальном органе Федеральной службы по надзору в
- 10. Государственный контроль (надзор) в сфере обращения лекарственных средств включает в себя: 1) лицензионный контроль в сфере
- 11. Структурные подразделения Системы контроля качества Центральный аппарат Росздравнадзора, его территориальные Управления, контрольно-испытательные лаборатории, единая информационная система,
- 12. На основании ст. 57. Федерального закона от 12.04.2010г. № 61-ФЗ «Об обращении лекарственных средств» в аптечных
- 13. Служба качества: реализует свои функции в соответствии со стандартами качества и их корректировкой с учетом особенностей
- 14. На что необходимо обращать внимание аптекам и учреждениям здравоохранения для того, чтобы сохранить качество закупленных медикаментов?
- 15. Закупка лекарственных средств должна осуществляться только у зарекомендовавших себя на рынке поставщиков, имеющих соответствующую лицензию.
- 16. Стадия поступления ЛС На стадии поступления лекарственных средств необходимо внимательно проверить наличие документов подтверждающих качество и
- 17. Приемочный контроль При поступления медикаментов должен быть проведен их тщательный приемочный контроль, включающий проверку условий транспортирования,
- 18. Процедуры приемочного контроля - проведение проверки на соответствие требованиям нормативных документов по показателям: «Описание», «Упаковка», «Маркировка»;
- 19. Поступившие лекарственные средства необходимо незамедлительно разместить по местам хранения с учетом: в первую очередь, требуемого температурного
- 20. Карантин При приемке, в случае сомнений в подлинности или в качестве поступающих лекарственных средств необходимо перевести
- 21. Уполномоченное лицо Уполномоченное лицо – это человек, который несет личную ответственность за функционирование системы качества организации,
- 22. Уполномоченный по качеству аптечного учреждения должен иметь свободный доступ к официальным сайтам Росздравнадзора и Центра контроля
- 23. В учреждениях должна быть разработана система быстрого оповещения в случае поступления официальной информации о выявлении фальсифицированного
- 24. Организация получения информации о запрещении обращения лекарственных средств: наличие в учреждении актуальной информации о лекарственных средствах,
- 25. Сведения о приостановлении или изъятии из обращения лекарственных средств размещены на официальном сайте Росздравнадзора www.roszdravnadzor.ru
- 26. Стадия хранения Во время нахождения лекарственных средств в аптечных и лечебных учреждениях необходимо контролировать не только
- 27. В процессе хранения контролируются показатели: Температуры влажности воздуха при выявлении любых отклонений принимаются меры по приведению
- 28. В феврале 2008г. вышла в свет 1 часть XII издания Государственной Фармакопеи Российской Федерации(XIV фармакопею от
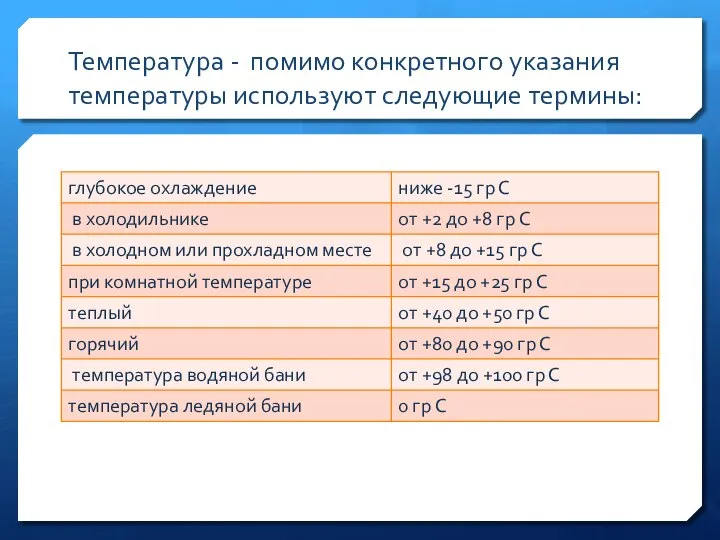
- 29. Температура - помимо конкретного указания температуры используют следующие термины:
- 30. Организация контроля соблюдения сроков годности лекарственных средств - наличие приказа руководителя учреждения о порядке ведения учета
- 31. Организация работы по изъятию из обращения, списанию и уничтожению лекарственных средств, запрещенных к обороту наличие информации
- 32. СИСТЕМА КАЧЕСТВА Успешное выполнение всех перечисленных мероприятий в аптечных организациях и учреждениях здравоохранения возможно при сформированной
- 34. Скачать презентацию





























 Организация репликации Microsoft SQL Server 2000 с учётом внешних и внутренних ограничений системы
Организация репликации Microsoft SQL Server 2000 с учётом внешних и внутренних ограничений системы Результаты работы в группе /секции №4
Результаты работы в группе /секции №4 Жизнь и творчество Льва Николаевича Толстого
Жизнь и творчество Льва Николаевича Толстого Презентация на тему Подготовка к взрослости
Презентация на тему Подготовка к взрослости  Фотоальбом
Фотоальбом Штрих в рисунке
Штрих в рисунке Инновационные стратегии
Инновационные стратегии Австралия не разгаданная тайна земли
Австралия не разгаданная тайна земли Матрица ОР
Матрица ОР Магистерская программа Бизнес и менеджмент (Business & Management)
Магистерская программа Бизнес и менеджмент (Business & Management) Призывнику
Призывнику БОРЬБА ЗА УДОВЛЕТВОРЕННОСТЬ КЛИЕНТОВ
БОРЬБА ЗА УДОВЛЕТВОРЕННОСТЬ КЛИЕНТОВ XIII Томский инновационный форум
XIII Томский инновационный форум Крещение (Богоявление)
Крещение (Богоявление) Образ Григория Мелехова
Образ Григория Мелехова Осторожно,железная дорога
Осторожно,железная дорога О С Т Е О П О Р О З
О С Т Е О П О Р О З Санкт-Петербургский государственный университетинформационных технологий, механики и оптики
Санкт-Петербургский государственный университетинформационных технологий, механики и оптики Развитие русской литературы 19 века
Развитие русской литературы 19 века Опорно-двигательный аппарат
Опорно-двигательный аппарат Аналитика: виды ROI
Аналитика: виды ROI Как формируются и утверждаются списки арбитражных заседателей. Тема 7. Вопрос 23
Как формируются и утверждаются списки арбитражных заседателей. Тема 7. Вопрос 23 Каменная архитектура
Каменная архитектура Физика и познание мира
Физика и познание мира Высокопроизводительные вычисления в системе управления жизненным циклом нефтегазовых месторождений
Высокопроизводительные вычисления в системе управления жизненным циклом нефтегазовых месторождений Аппаратные средства
Аппаратные средства Лукойл запускает проект Старт в будущее
Лукойл запускает проект Старт в будущее Конструкция: часть и целое здание как сочетание различных объемов
Конструкция: часть и целое здание как сочетание различных объемов