Содержание
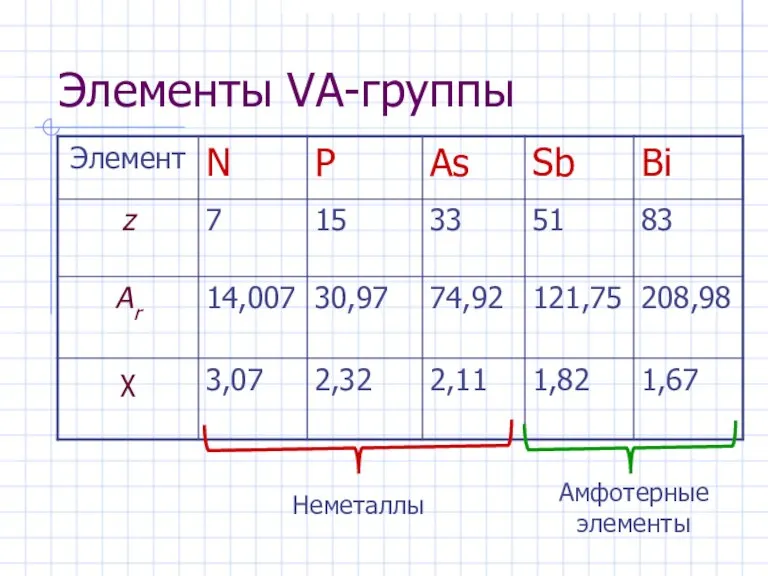
- 2. Элементы VA-группы
- 3. Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3 Степени окисления: –III, 0, +III,
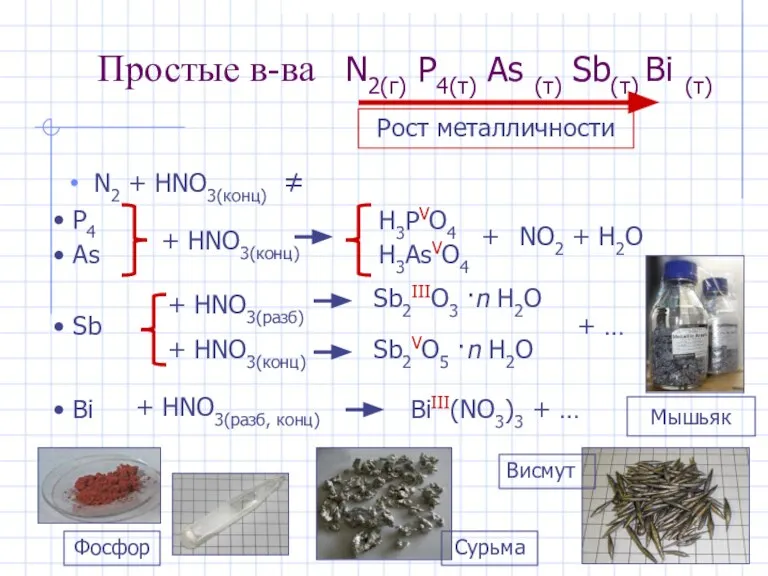
- 4. Простые в-ва N2(г) P4(т) As (т) Sb(т) Bi (т) N2 + HNO3(конц) ≠ P4 As +
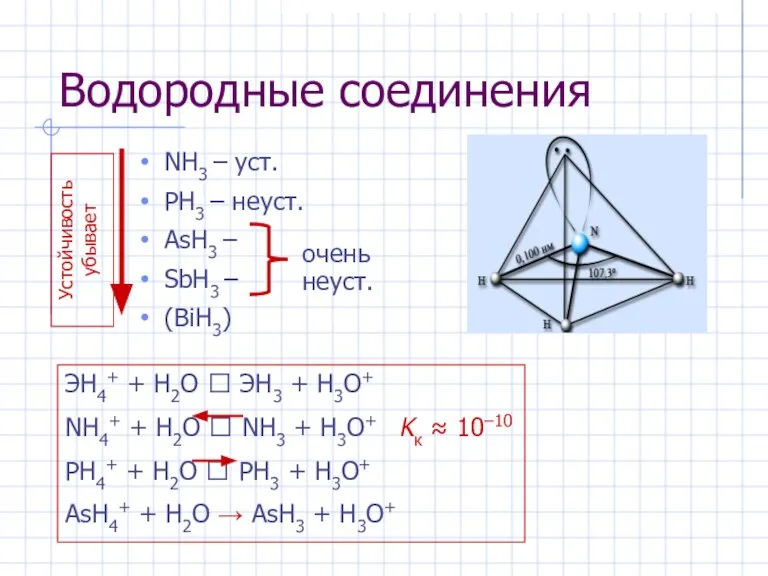
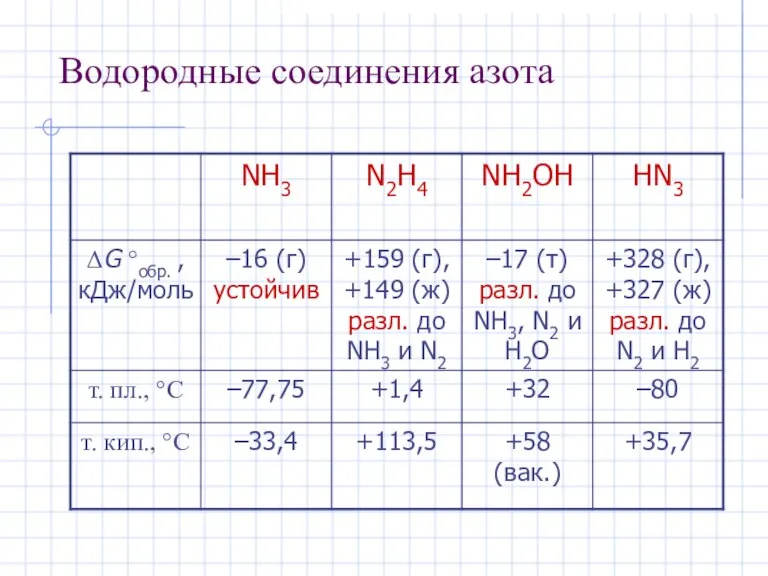
- 5. Водородные соединения NH3 – уст. PH3 – неуст. AsH3 – SbH3 – (BiH3) Устойчивость убывает очень
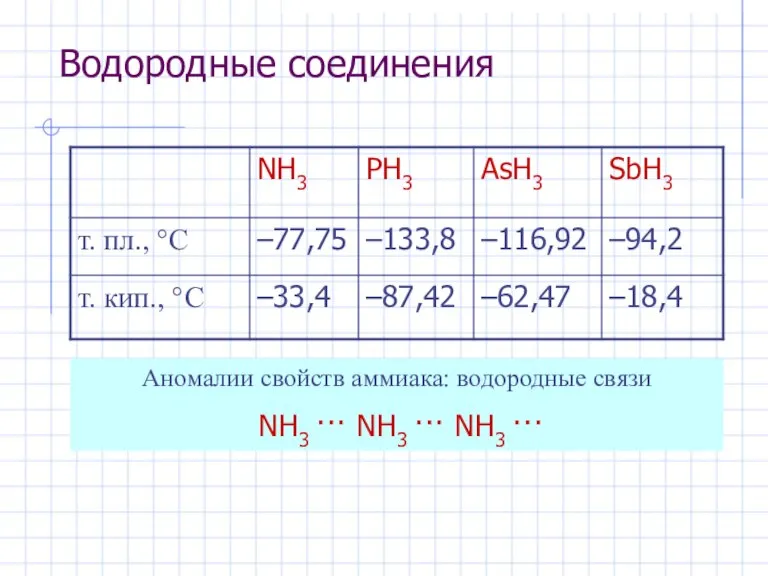
- 6. Водородные соединения Аномалии свойств аммиака: водородные связи NH3 ··· NH3 ··· NH3 ···
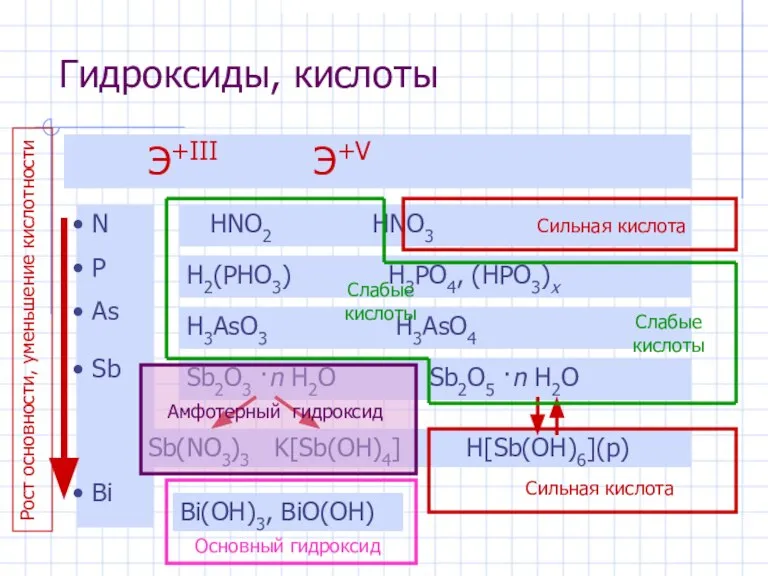
- 7. Гидроксиды, кислоты Э+III Э+V N P As Sb Bi HNO2 HNO3 H2(PHO3) H3PO4, (HPO3)x H3AsO3 H3AsO4
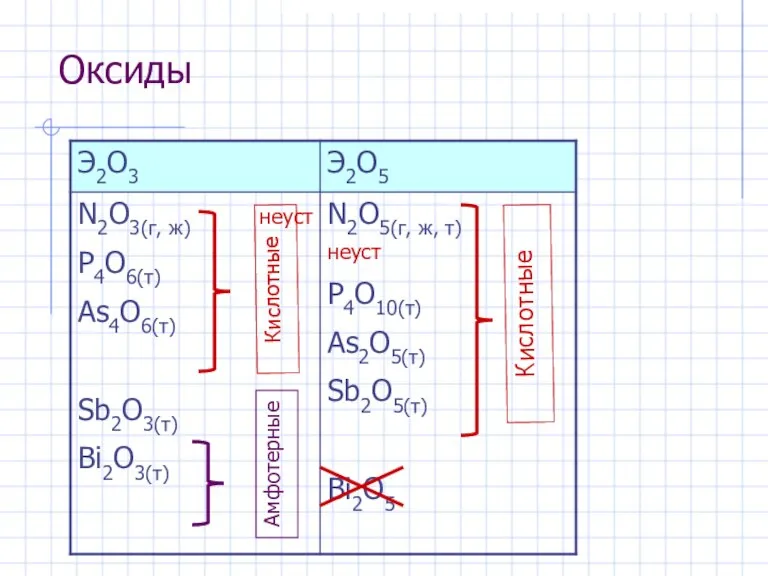
- 8. Оксиды
- 9. Степени окисления Ст.ок. +V: P, As, Sb N(+V), Bi(+V) – сильные окислители Ст.ок. +III: P, As,
- 10. Распространение в природе 12. P – 0,09 масс.% 16. N – 0,03 масс.% 47. As –
- 11. Нитратин (чилийская селитра) NaNO3 Нитрокалит (индийская селитра) KNO3 Нашатырь NH4Cl Апатит 3Ca3(PO4)2·Ca(Cl,OH,F)2 Фосфорит Ca3(PO4)2 Фторапатит 3Ca3(PO4)2·CaF2
- 12. Мышьяк, сурьма, висмут Реальгар As4S4 Аурипигмент As2S3 Арсенопирит FeAsS Тетраэдрит Cul2As4S13 Антимонит (сурьмяный блеск) Sb2S3 Висмутин
- 13. История открытия элементов Азот: 1772 г., Д. Резерфорд, Г.Кавендиш, 1769-1771 гг., К.Шееле, А.Л. Лавуазье Фосфор: 1669
- 14. Азот. Шкала степеней окисления N2O5, NO3−, HNO3, NaNO3, AgNO3 NO2, N2O4 N2O3, NO2−, HNO2, NaNO2, NF3
- 15. Свойства азота N2 – бесцветный газ, без запаха и вкуса, т.пл. –210,0 °С, т.кип. –195,8 °С
- 16. Получение и применение азота В промышленности: фракционная дистилляция сжиженного воздуха (жидкий кислород остается в жидкой фазе).
- 17. Водородные соединения азота
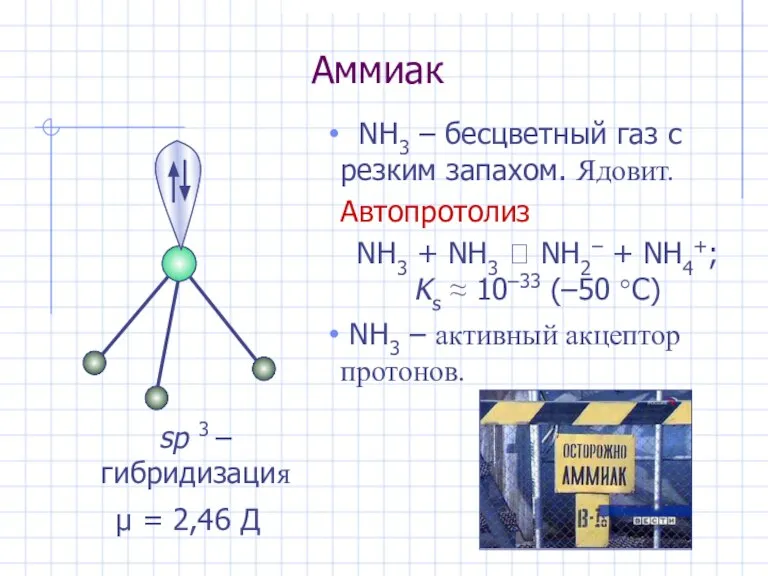
- 18. Аммиак NH3 – бесцветный газ с резким запахом. Ядовит. Автопротолиз NH3 + NH3 ⮀ NH2– +
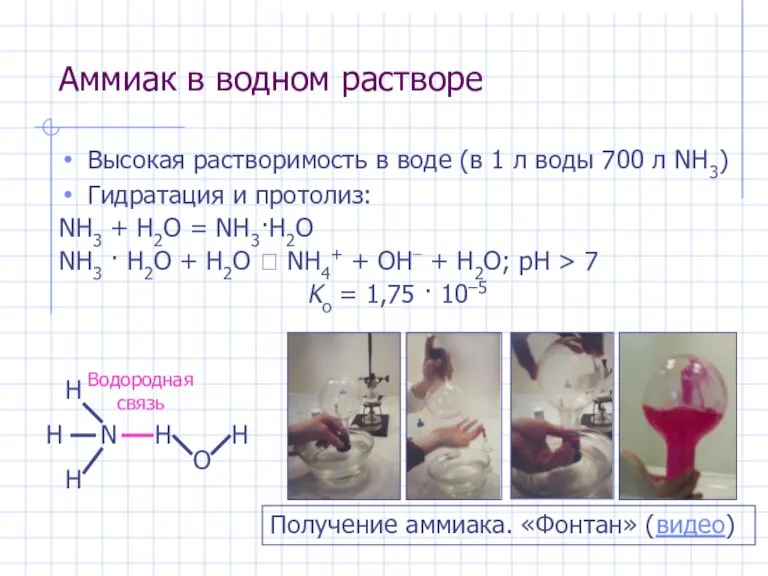
- 19. Аммиак в водном растворе Высокая растворимость в воде (в 1 л воды 700 л NH3) Гидратация
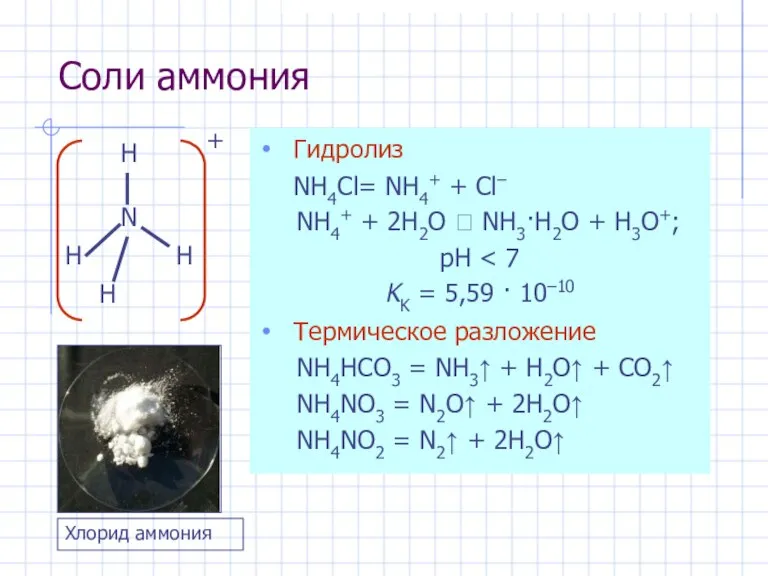
- 20. Соли аммония Гидролиз NH4Cl= NH4+ + Cl– NH4+ + 2H2O ⮀ NH3·H2O + H3O+; pH KK
- 21. Окислительно-восстановительные свойства Горение 4 NH3 + 3O2 = 2N2 + 6H2O (без кат.) 4 NH3 +
- 22. Получение аммиака В промышленности N2 + 3H2 ⮀ 2NH3 + Q (300-500 °С, 300 атм, катализатор:
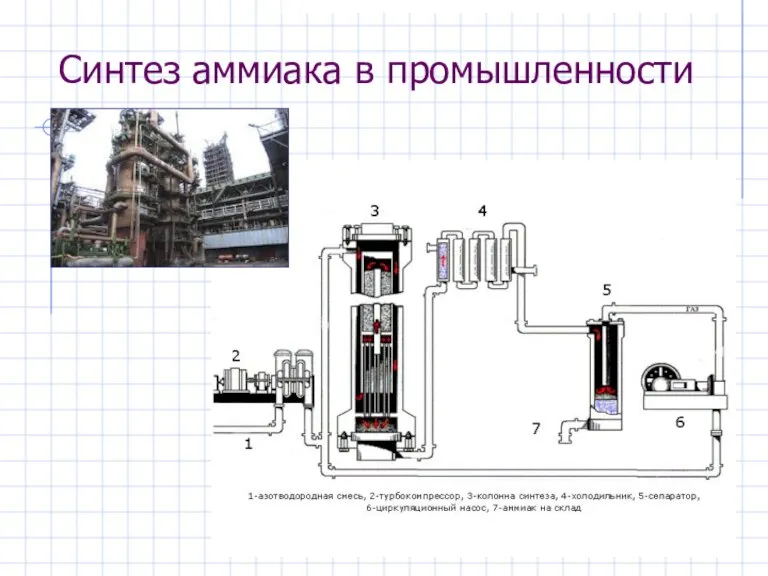
- 23. Синтез аммиака в промышленности
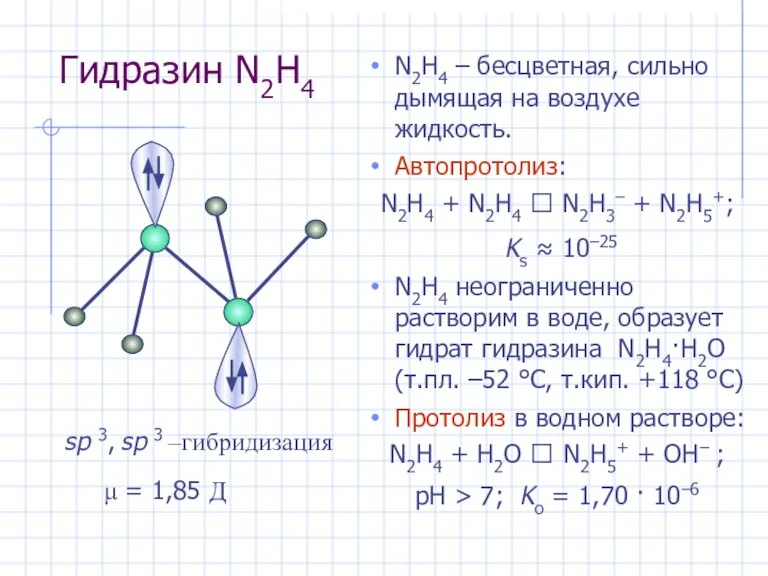
- 24. Гидразин N2H4 N2H4 – бесцветная, сильно дымящая на воздухе жидкость. Автопротолиз: N2H4 + N2H4 ⮀ N2H3–
- 25. Протоноакцепторные свойства N2H4 – акцептор протонов (две неподеленные пары электронов): N2H4 + H3O+ = N2H5+ +
- 26. Окислительно-восстановительные свойства гидразина Гидразин как восстановитель рН > 7: N2H4·H2O + 4OH− −4e − = N2
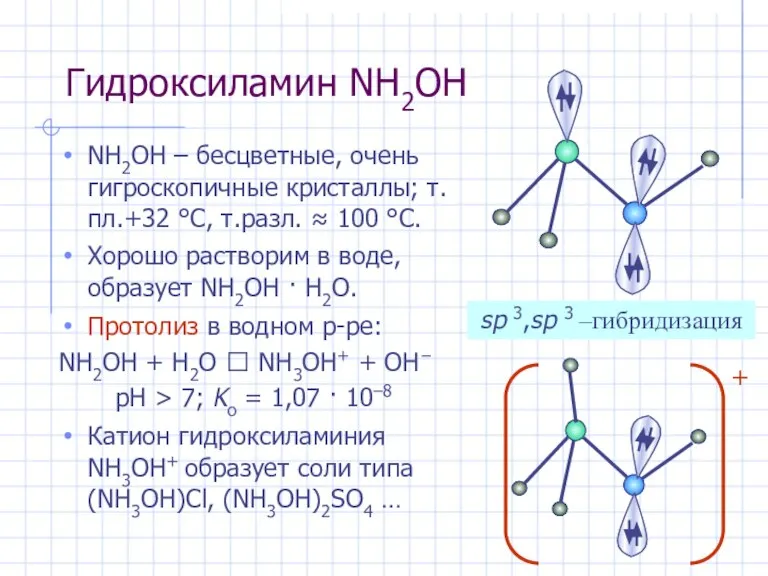
- 27. Гидроксиламин NH2OH NH2OH – бесцветные, очень гигроскопичные кристаллы; т.пл.+32 °С, т.разл. ≈ 100 °С. Хорошо растворим
- 28. Окислительно-восстановительные свойства гидроксиламина Гидроксиламин как восстановитель рН > 7: 2(NH2OH·H2O) + 2OH− −2e − = N2
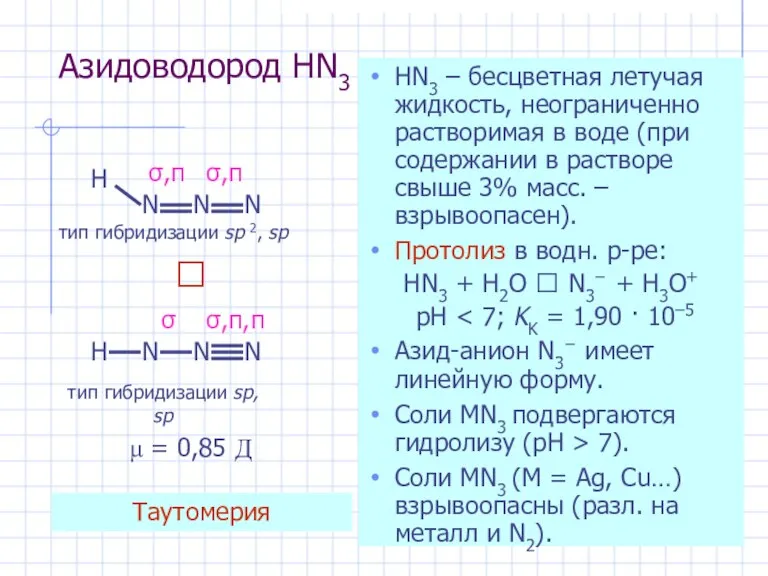
- 29. Азидоводород HN3 HN3 – бесцветная летучая жидкость, неограниченно растворимая в воде (при содержании в растворе свыше
- 31. Скачать презентацию
![Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3 Степени](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336140/slide-2.jpg)













 Собори, які побудовані у готичному стилі
Собори, які побудовані у готичному стилі Презентация на тему Декабристы в Сибири
Презентация на тему Декабристы в Сибири Карманные деньги: за и против
Карманные деньги: за и против Unemployment and inflation
Unemployment and inflation Мохнатая азбука
Мохнатая азбука Франция. XVI – XVII вв
Франция. XVI – XVII вв Кафедра лучевой диагностики и лучевой терапии
Кафедра лучевой диагностики и лучевой терапии Przed Świętem Paschy
Przed Świętem Paschy Презентация на тему Нахождение числа по его дроби
Презентация на тему Нахождение числа по его дроби  Открытый урок химии по теме «Глюкоза»
Открытый урок химии по теме «Глюкоза» Национальные особенности русской философии
Национальные особенности русской философии Презентация на тему БАТИК
Презентация на тему БАТИК  МБОУ г. Иркутска СОШ № 7Команда представляет сказку с одноименным названием «В норку за Кроликом»
МБОУ г. Иркутска СОШ № 7Команда представляет сказку с одноименным названием «В норку за Кроликом» Bridgewater raritan regional school district
Bridgewater raritan regional school district Отгадай ютубера по картинке 3
Отгадай ютубера по картинке 3 наречие
наречие Хронический гепатит
Хронический гепатит Церковные одежды
Церковные одежды День конституции. Познавательная викторина
День конституции. Познавательная викторина Характеристика специализации основных сельскохозяйственных районов Китая, объяснение причин
Характеристика специализации основных сельскохозяйственных районов Китая, объяснение причин Договор в российском гражданском праве. Как правильно заключать договоры
Договор в российском гражданском праве. Как правильно заключать договоры Тема 4- Расстройства кровообращения 1: венозный застой, кровотечение, кровоизлияние. Шок Вопросы: 1-Полнокровие, классификация, Морф
Тема 4- Расстройства кровообращения 1: венозный застой, кровотечение, кровоизлияние. Шок Вопросы: 1-Полнокровие, классификация, Морф Петербургское образование
Петербургское образование Magniy_Kinakh_12_gr-WPS_Office
Magniy_Kinakh_12_gr-WPS_Office Методические указания к выполнению практических работ по учебной дисциплине «Информационные технологии в профессиональной деят
Методические указания к выполнению практических работ по учебной дисциплине «Информационные технологии в профессиональной деят Пара сил Статика
Пара сил Статика  Сексуальные мотивы в рекламе
Сексуальные мотивы в рекламе Загадки
Загадки