Очень древний я металл, Счет столетьям потерял; Наблюдатель египтянин имя дал «небесный камень» Был нескромным я в меру, Тысячи лет
Содержание
- 2. Очень древний я металл, Счет столетьям потерял; Наблюдатель египтянин имя дал «небесный камень» Был нескромным я
- 3. ЖЕЛЕЗО
- 4. Технологическая карта
- 5. Историческая справка о железе Слово «железо» произошло от санскритских слов «джальжа» (металл, руда) или «жель» (блистать,
- 6. Изотопы железа
- 7. Строение атома железа. Fe (железо) Порядковый номер: 26 Период: IV Группа: VIII Подгруппа: В Электронное строение
- 8. Распространение в природе Содержание в земной коре. В земной коре содержится 4,65%(по массе) железа. По распространенности
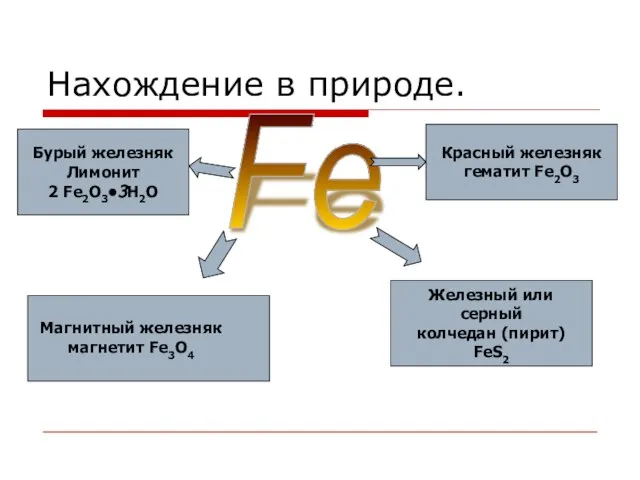
- 9. Нахождение в природе. Fe Магнитный железняк магнетит Fe3O4 Красный железняк гематит Fe2O3 Бурый железняк Лимонит 2
- 10. Пирит Химическая формула FeS2 Сингония:кубическая Удельный вес: (г/см3)5—5,2 Цвет:соломенно-желтый, иногда с побежалостью. Цвет, черты:зеленовато-черная Блеск:металлический Излом:раковистый
- 11. Сидерит Химическая формула FеСО3 Сингония:тригональная Удельный вес:(г/см3)3,7—3,9 Цвет:желтый, желтовато-серый, буровато-серый, буровато-желтый, черный Цвет, черты:бесцветная, у измененных
- 12. Гематит Химическая формула Fе2O3 Сингония:тригональная Удельный вес: (г/см3)5,3 Цвет:от черного в крупнокристаллических агрегатах до ярко-красного в
- 13. Магнетит Химическая формула FеFе2O4 Сингония:кубическая Удельный вес: (г/см3)5,2 Цвет:железо-черный, иногда с синей побежалостью Цвет, черты:черная Блеск:металлический
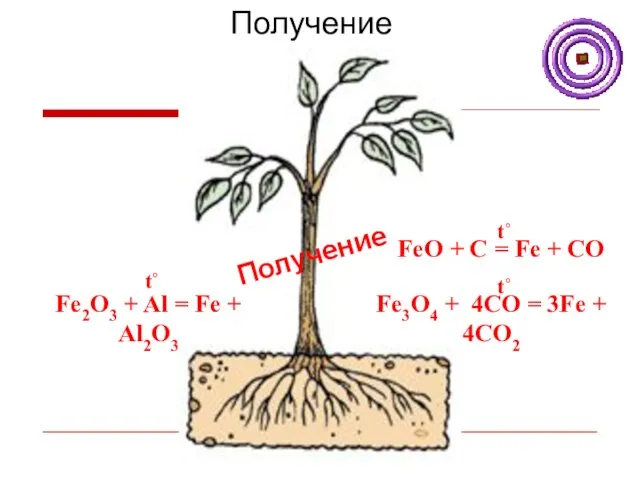
- 14. Получение железа FeO + C = Fe + CO t˚ Fe3O4 + 4CO = 3Fe +
- 15. Физические свойства Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения
- 16. Химические свойства железа 1. Железо реагирует с неметаллами: Fe + S = FeS При нагревании до
- 17. Химические свойства железа 2. Железо реагирует с кислотами. Fe+H2SO4=FeSO4+H2 Fe +2 HCl = FeCl2 + H2
- 18. Химические свойства железа. 3. Реагирует с растворами солей металла согласно электрохимическому ряду напряжений металлов. Fe +
- 19. Биологическая роль железа: Железо — наиболее распространенный в организме d-элемент. В организме человека его содержится около
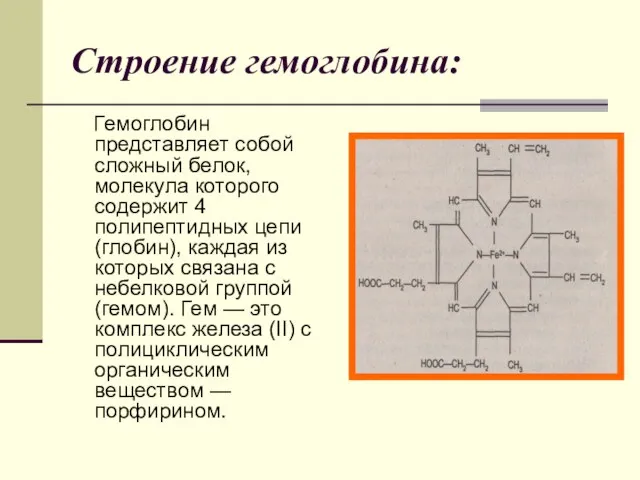
- 20. Строение гемоглобина: Гемоглобин представляет собой сложный белок, молекула которого содержит 4 полипептидных цепи (глобин), каждая из
- 21. Ферментативная роль железа: Железо входит также в состав большой группы ферментов, катализирующих процесс переноса электронов в
- 22. Применение железа и его соединений в медицине: Железный купорос FеSО4 • 7Н2О используют при лечении анемии,
- 23. Применение железа: «Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления сердечников, трансфо-,
- 24. Технологическая карта
- 25. Химический диктант 1. Железо – это активный щелочной металл 2. Железо легко куется. 3. Железо взаимодействует
- 27. Скачать презентацию





















 Стандарт cXML в корпоративных приложениях электронной коммерции
Стандарт cXML в корпоративных приложениях электронной коммерции Целл-у-лосс - новинка от Herbalife. Деликатное выведение лишней жидкости из организма
Целл-у-лосс - новинка от Herbalife. Деликатное выведение лишней жидкости из организма Улица Горьковская д. 63. Планируемые мероприятия
Улица Горьковская д. 63. Планируемые мероприятия Организация аварийно-спасательных работ
Организация аварийно-спасательных работ Знаток правил дорожного движения Знаток правил дорожного движения Юсупова Ирина Равиловна МОУ «СОШ 60», г. Набережные Челны.
Знаток правил дорожного движения Знаток правил дорожного движения Юсупова Ирина Равиловна МОУ «СОШ 60», г. Набережные Челны. Контроль якості металів і зварних з'єднань
Контроль якості металів і зварних з'єднань C новым учебным годом!!! 2012/13
C новым учебным годом!!! 2012/13 Презентация на тему Физика твердого тела Кристаллофизика
Презентация на тему Физика твердого тела Кристаллофизика
 посвящение в читатели
посвящение в читатели Строим домик из спичек
Строим домик из спичек Дню Защитника Отечества посвящается
Дню Защитника Отечества посвящается Изобразительность в музыке
Изобразительность в музыке SWOT-анализ
SWOT-анализ Народное прикладное искусство
Народное прикладное искусство Творчы праэкт Humanities Blues
Творчы праэкт Humanities Blues Рудольф Арнхейм
Рудольф Арнхейм Пэчворк
Пэчворк Особенности психологического сопровождения детей с ограниченными возможностями здоровья в условиях ДОУ
Особенности психологического сопровождения детей с ограниченными возможностями здоровья в условиях ДОУ Золотое сечение на Новгородчине
Золотое сечение на Новгородчине 家人
家人 Внешняя политика СССР в 1985-1991 гг
Внешняя политика СССР в 1985-1991 гг Жилищное право
Жилищное право Презентация на тему Социальная сфера презентация
Презентация на тему Социальная сфера презентация Экслибрис. Задание по прикладной композиции
Экслибрис. Задание по прикладной композиции Итоги интернет-урока«LEARNING MORE ABOUT LONDON / УЗНАЕМ БОЛЬШЕ О ЛОНДОНЕ»
Итоги интернет-урока«LEARNING MORE ABOUT LONDON / УЗНАЕМ БОЛЬШЕ О ЛОНДОНЕ» Хить Александр АнатольевичГенеральный директор ООО "Ассистанская компания"Украинская служба помощи" тел. 8 067 630 70 88 e-mail:
Хить Александр АнатольевичГенеральный директор ООО "Ассистанская компания"Украинская служба помощи" тел. 8 067 630 70 88 e-mail:  Олимпийское движение в России
Олимпийское движение в России Мышление. Тест Какой у вас тип мышления
Мышление. Тест Какой у вас тип мышления