Слайд 2План лекции:
Использование ОВР в аналитической химии.
Типы ОВР.
Количественное описание ОВР.
Константа равновесия ОВР.

Устойчивость водных растворов окислителей и восстановителей.
Слайд 3Использование ОВР в аналитической химии
При пробоподготовке для переведения в раствор пробы.
Для разделения

смеси ионов.
Для маскирования.
Для проведения реакций обнаружения катионов и анионов в качественном химическом анализе.
В титриметрическом анализе.
В электрохимических методах анализа.
Слайд 4 Например, при гипоксии (состояние кислородного голодания) происходит замедление транспорта Н+ и е

– в дыхательной цепи и накопление восстановленных форм соединений. Этот сдвиг сопровождается снижением ОВ потенциала (ОВП) ткани и по мере углубления ишемии (местное малокровие, недостаточное содержание крови в органе или ткани) ОВП снижается. Это связано как с угнетением процессов окисления вследствие недостатка кислорода и нарушения каталитической способности окислительно-восстановительных ферментов, так и с активацией процессов восстановления в ходе гликолиза.
Слайд 5 Типы ОВР
1. Межмолекулярные – изменяются степени окисления (С.О.) атомов элементов, входящих в

состав разных веществ:
Слайд 6
2. Внутримолекулярные – окислитель и восстановитель - атомы одной молекулы:

Слайд 7
3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент повышает

и понижает С.О.
Cl2 - является окислителем и восстановителем.
Слайд 8 Количественное описание ОВР
Например, чем сильнее основание, тем больше его сродство в протону.

Также и сильный окислитель обладает большим сродством к электрону.
Например, в кислотно-основных реакциях участвует растворитель (вода), отдавая и принимая протон, а в ОВР вода тоже может терять или присоединять электрон.
Например, для проведения кислотно-основных реакций необходимы как кислота, так и основание, а в ОВР – и окислитель и восстановитель.
Слайд 9 Рассматривая ОВ пару в целом, можно записать схематичное уравнение реакции:
Ox + nē

= Red
Равновесие в растворе можно описать с помощью равновесного потенциала, который зависит от состава раствора по уравнению Нернста:
Слайд 10 При температуре 298 К уравнение Нернста принимает вид:

Слайд 11 Непосредственно измерить электродный потенциал сложно, поэтому все электродные потенциалы сравнивают с каким-либо
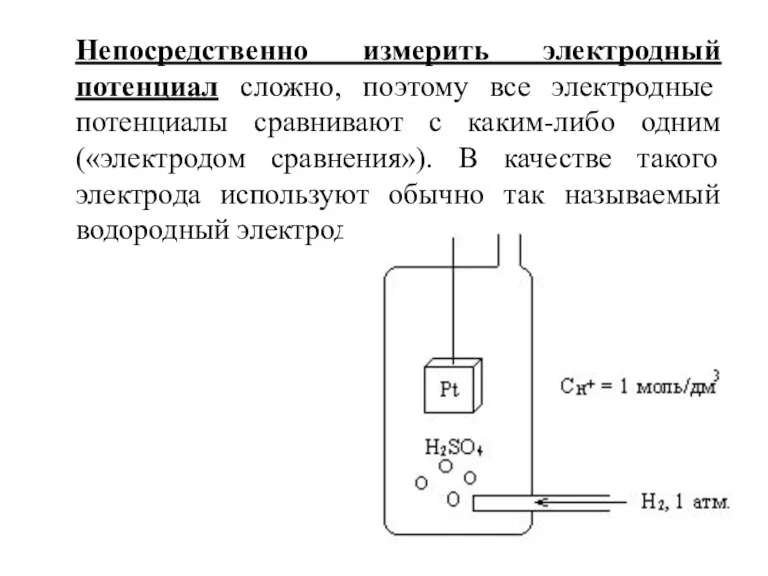
одним («электродом сравнения»). В качестве такого электрода используют обычно так называемый водородный электрод.
Слайд 12 В уравнении Нернста можно использовать вместо активностей ионов их концентрации, но тогда

необходимо знать коэффициенты активностей ионов:
Слайд 13 На силу окислителя и восстановителя могут влиять:
значение рН,
реакции осаждения
реакции

комплексообразования.
Тогда свойства редокс-пары будут описываться реальным потенциалом.
Слайд 14 Для расчета реального потенциала полуреакций, получаемых сочетанием
ОВР и реакций осаждения, используются

формулы:
∙ если окисленная форма представляет собой малорастворимое соединение:
Слайд 15∙ если восстановленная форма представляет собой малорастворимое соединение:

Слайд 16Сочетание ОВР и реакций комплексообразования
∙ если окисленная форма связана в комплекс:

Слайд 17
∙ если восстановленная форма связана в комплекс:

Слайд 18
∙ если обе формы связаны в комплекс:
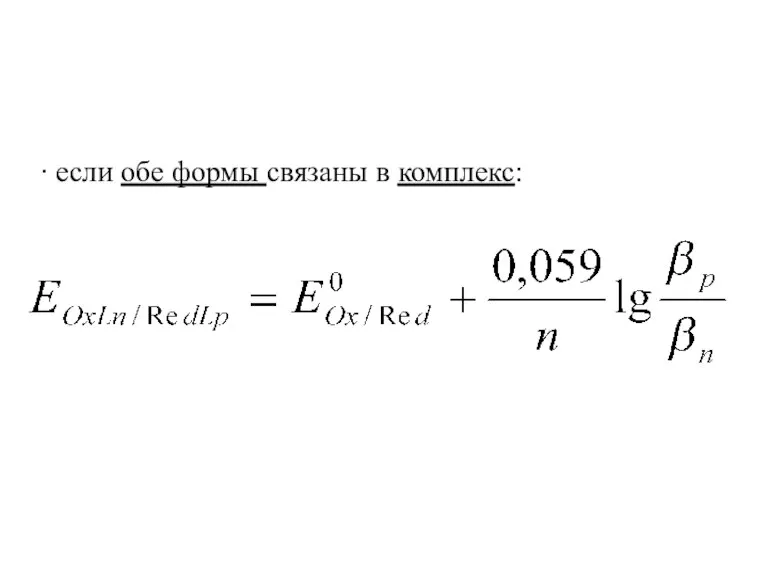
Слайд 19Сочетание ОВР и реакций протонирования
если протонируется окисленная форма:

Слайд 20
если протонируется восстановленная форма:

Слайд 22если реакция протекает по следующему уравнению:
Ox + mH+ + nē =

Red + H2O
тогда
Слайд 23Константа равновесия ОВР
Расчет константы равновесия для реакции:
Sn2+ + 2Fe3+ = Sn4+ +

2Fe2+
Константа равновесия рассчитывается:
Слайд 24Выражения для реальных ОВ потенциалов каждой редокс-пары будут выглядеть следующим образом:

Слайд 26Проведя математические операции, получим:
К = 1021

Слайд 27 Используя приведенное вычисление константы равновесия, получим для любого обратимого ОВ процесса при

20 0С следующее уравнение:
Слайд 28Например, в цериметрии (окислитель Се4+):
Fe2+ + Се4+ = Fe3+ + Се3+
К

= 1011,4 = 2,3 · 1011


























 Госзакупки. С чего начать
Госзакупки. С чего начать Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов.
Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов. Всього одна чарка
Всього одна чарка ИЗУЧАЕМ EXCEL
ИЗУЧАЕМ EXCEL Институт кураторов — копия
Институт кураторов — копия Богатыри - герои былин
Богатыри - герои былин Острые респираторные заболевания и их профилактика
Острые респираторные заболевания и их профилактика Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га
Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га Геометрия в моде
Геометрия в моде Презентация на тему Аллея героев Первой мировой войны
Презентация на тему Аллея героев Первой мировой войны Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз
Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз CHOOSING A PROFESSION
CHOOSING A PROFESSION внутреннее строение насекомых
внутреннее строение насекомых 984967 (3)
984967 (3) Условие не превышения границы области допустимых состояний конструкции
Условие не превышения границы области допустимых состояний конструкции Положение об общественном совете муниципального образования
Положение об общественном совете муниципального образования Традиции модернизма в искусстве 2-й пол. ХХ века
Традиции модернизма в искусстве 2-й пол. ХХ века Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус
Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус Полные квадратные уравнения
Полные квадратные уравнения Сегментация изображений
Сегментация изображений Конституция Республики Молдова
Конституция Республики Молдова Методическая работа школы
Методическая работа школы Набор в секции. Отделение сложно-координационных видов
Набор в секции. Отделение сложно-координационных видов Виктор Федорович Боков
Виктор Федорович Боков Chapter-8. Learning goals
Chapter-8. Learning goals Методи цитологічних досліджень
Методи цитологічних досліджень Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра
Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force
Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force