Содержание
- 2. Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ,
- 3. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Атом превращается в положительно заряженный ион: Zn0
- 4. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Атом превращается в отрицательно заряженный ион S0
- 5. Восстановители - атомы, молекулы или ионы, отдающие электроны. Они в процессе ОВР окисляются Типичные восстановители: ●
- 6. Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они в процессе ОВР восстанавливаются Типичные окислители: ●
- 7. На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или иона. Чем прочнее частица, тем
- 8. Например, азот имеет высокую электроотрицательность и мог бы быть сильным окислителем в виде простого вещества, но
- 9. Или НСLO более сильный окислитель в растворе, чем НСLO4, так как НСLO – менее устойчивая кислота.
- 10. Если химический элемент находится в промежуточной степени окисления, то он проявляет свойства и окислителя, и восстановителя.
- 11. Степени окисления серы: -2,0,+4,+6 Н2S-2 - восстановитель 2Н2S+3O2=2H2O+2SO2 S0,S+4O2 – окислитель и восстановитель S+O2=SO2 2SO2+O2=2SO3 (восстановитель)
- 12. Определение степеней окисления атомов химических элементов С.о. атомов х/э в составе простого вущества = 0 Алгебраическая
- 13. Классификация окислительно-восстановительных реакций Реакции межмолекулярного окисления 2Al0 + 3Cl20 → 2Al+3 Cl3-1 Реакции внутримолекулярного окисления 2KCl+5O3-2
- 14. Это полезно знать Степени окисления элементов в составе аниона соли такие же, как и в кислоте,
- 15. Окислительные свойства концентрированной серной кислоты Продукты восстановления серы: H2SO4 + оч.акт. металл (Mg, Li, Na…) →
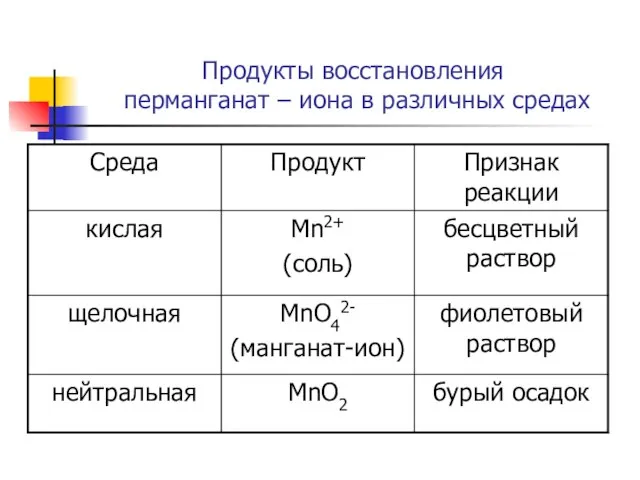
- 16. Продукты восстановления перманганат – иона в различных средах
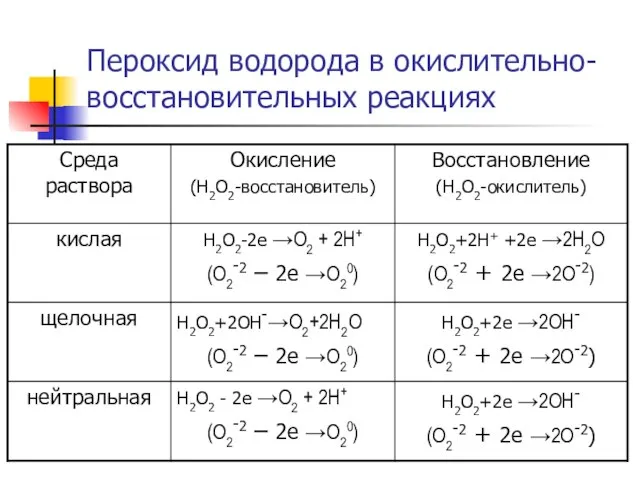
- 17. Пероксид водорода в окислительно-восстановительных реакциях
- 18. Азотная кислота в окислительно-восстановительных реакциях Продукты восстановления азота: Концентрированная HNO3: N+5 +1e → N+4 (NO2) (Ni,
- 20. Скачать презентацию















 Решения для бизнеса, основанные на открытом программном коде
Решения для бизнеса, основанные на открытом программном коде Штат Айова
Штат Айова Викторина «Золотое кольцо России»
Викторина «Золотое кольцо России» Стандартизация в России и других странах
Стандартизация в России и других странах Презентация на тему Физика твердого тела Кристаллофизика
Презентация на тему Физика твердого тела Кристаллофизика
 Технический анализ ценных бумаг
Технический анализ ценных бумаг Анализ диалогов из фильма Ирония судьбы
Анализ диалогов из фильма Ирония судьбы Природно-ресурсный потенциал России
Природно-ресурсный потенциал России Презентация на тему Древнегреческая цивилизация
Презентация на тему Древнегреческая цивилизация  Дыхательная гимнастика
Дыхательная гимнастика Проект Ботанический Сад
Проект Ботанический Сад Игры XXII Олимпиады
Игры XXII Олимпиады Лист. Строение листа
Лист. Строение листа Звездочёт
Звездочёт Договор транспортной экспедиции
Договор транспортной экспедиции АКСАКОВ КОНСТАНТИН СЕРГЕЕВИЧ (1817–1860)
АКСАКОВ КОНСТАНТИН СЕРГЕЕВИЧ (1817–1860) Организация труда персонала в ресторане высшего класса общегородского типа при подготовке банкета-коктейль-фуршет на 100 человек
Организация труда персонала в ресторане высшего класса общегородского типа при подготовке банкета-коктейль-фуршет на 100 человек Система «1С:Образование 4». Организация учебного процесса на основе цифровых образовательных ресурсов
Система «1С:Образование 4». Организация учебного процесса на основе цифровых образовательных ресурсов Практикум-18Воля и мотивация
Практикум-18Воля и мотивация Свойства параллелепипеда
Свойства параллелепипеда Развитие культуры письменной речи младших школьников на уроках русского языка
Развитие культуры письменной речи младших школьников на уроках русского языка Как сохранить значимые социально-политические особенности на фоне интернационализма
Как сохранить значимые социально-политические особенности на фоне интернационализма Raportul departamentului local de proiecte și constucții
Raportul departamentului local de proiecte și constucții Заполнение Психоматрицы. Занятие 2
Заполнение Психоматрицы. Занятие 2 Аэротренажер. Модернизация тренажера
Аэротренажер. Модернизация тренажера Рождественский турнир по хоккею с шайбой среди любительских команд
Рождественский турнир по хоккею с шайбой среди любительских команд Использование кавалетти для подготовки всадников в конкуре
Использование кавалетти для подготовки всадников в конкуре Семья Соколовых
Семья Соколовых