Содержание
- 3. Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит» Задачи урока: Познакомиться с понятиями: ОВР, окисление, восстановление,
- 4. Входной контроль 1 вариант 1 - Г 2 - А 3 – Г 4 – А
- 5. Лабораторная работа А) Проведите химические реакции Взаимодействия железа с сульфатом меди Взаимодействия растворов сульфата меди и
- 6. Fe0+Cu+2 SO4 = Fe SO4 + Сu +2 0 Суть ОВР – переход электронов от одних
- 7. Какие два процесса происходят в ОВР? Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4 Fe0 → Fe+2
- 8. Окислитель Восстановитель Fe Cu+2
- 9. Внимание!!! Самостоятельная работа...
- 10. Уэ-1 Значение ОВР ОВР обеспечивают жизненно важные процессы организмов. Используются для получения различных веществ; для теплообеспечения
- 11. УЭ-2 Распознавание ОВР по химическим уравнениям Окислительно-восстановительную реакцию можно определить по изменению степени окисления у отдельных
- 12. УЭ-3 Процессы окисления и восстановления. 1. А) окисление (ок-ие),восстановитель (в-ль) Б) восстановление (в-ие), окислитель (ок-ль) В)
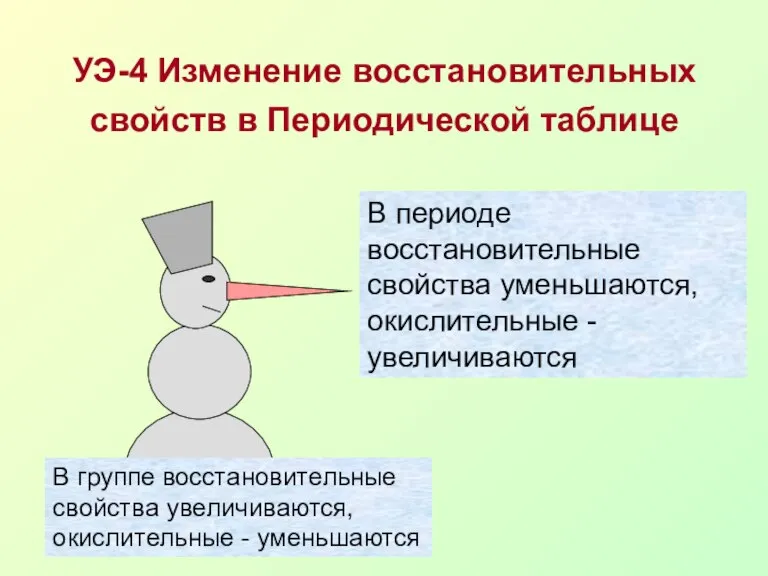
- 13. УЭ-4 Изменение восстановительных свойств в Периодической таблице В периоде восстановительные свойства уменьшаются, окислительные - увеличиваются В
- 14. УЭ-4 Изменение восстановительных свойств в Периодической таблице 2. а) Li, Na, K б) S, Si, Na
- 15. Выходной контроль 1 - Б 2 - Б 3 - В 4 - А 5 -
- 16. 1 Вариант С0 + О20 = С+4О2-2 C0 - 4e = C+4 - ок-ие, в-ль O0
- 17. Домашнее задание Стр. 229-231, выучить определения. Стр.235. упр 1( «3») упр 1,3 («4») упр 1, 3,
- 18. Закончите схемы процессов, укажите окислитель и восстановитель: Na …… = Na+ S-2 …… = S0 S-2
- 19. выводы: 1)овр чрезвычайно распространены; 2)суть овр-переход электронов от одних атомов,молекул или ионов к другим; 3)овр-единство двух
- 20. е Окислительно-восстановительные реакции в природе и жизни человека: 1. Фотосинтез 2.Реакции круговорота веществ в природе 3.
- 21. 2KMnO4 = K2MnO4 + MnO2 + O2 2) Cu(OH)2 = CuO + H2O
- 23. Скачать презентацию


















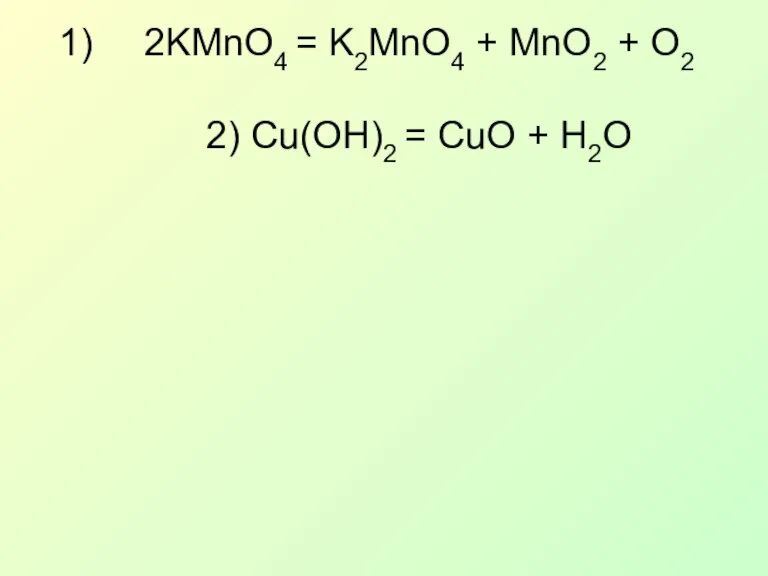
 Госзакупки. С чего начать
Госзакупки. С чего начать Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов.
Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов. Всього одна чарка
Всього одна чарка ИЗУЧАЕМ EXCEL
ИЗУЧАЕМ EXCEL Институт кураторов — копия
Институт кураторов — копия Богатыри - герои былин
Богатыри - герои былин Острые респираторные заболевания и их профилактика
Острые респираторные заболевания и их профилактика Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га
Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га Геометрия в моде
Геометрия в моде Презентация на тему Аллея героев Первой мировой войны
Презентация на тему Аллея героев Первой мировой войны Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз
Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз CHOOSING A PROFESSION
CHOOSING A PROFESSION внутреннее строение насекомых
внутреннее строение насекомых 984967 (3)
984967 (3) Условие не превышения границы области допустимых состояний конструкции
Условие не превышения границы области допустимых состояний конструкции Положение об общественном совете муниципального образования
Положение об общественном совете муниципального образования Традиции модернизма в искусстве 2-й пол. ХХ века
Традиции модернизма в искусстве 2-й пол. ХХ века Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус
Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус Полные квадратные уравнения
Полные квадратные уравнения Сегментация изображений
Сегментация изображений Конституция Республики Молдова
Конституция Республики Молдова Методическая работа школы
Методическая работа школы Набор в секции. Отделение сложно-координационных видов
Набор в секции. Отделение сложно-координационных видов Виктор Федорович Боков
Виктор Федорович Боков Chapter-8. Learning goals
Chapter-8. Learning goals Методи цитологічних досліджень
Методи цитологічних досліджень Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра
Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force
Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force