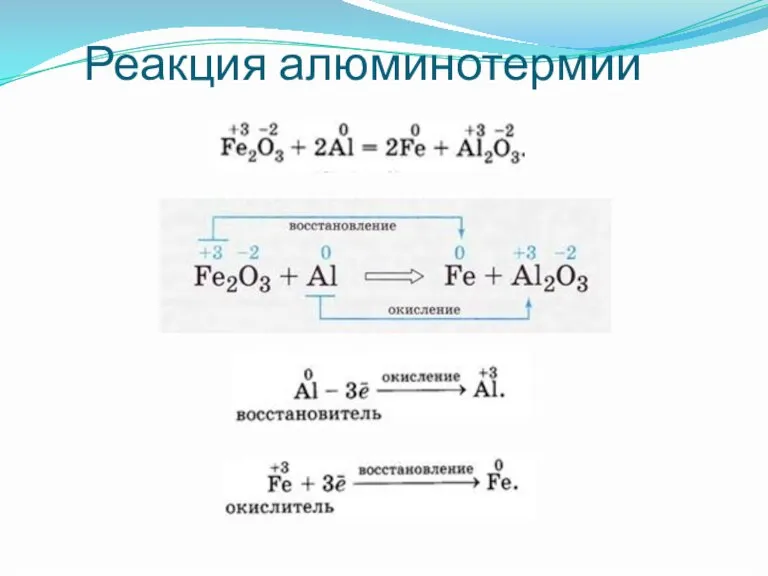
Слайд 2Окислительно-восстановительными называют реакции, протекающие с изменением степеней окисления элементов, образующих вещества, участвующие

в реакции.
Степенью окисления называют условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что оно состоит только из простых ионов.
Слайд 3
Для того чтобы рассчитать степень окисления, нужно воспользоваться несложными правилами:

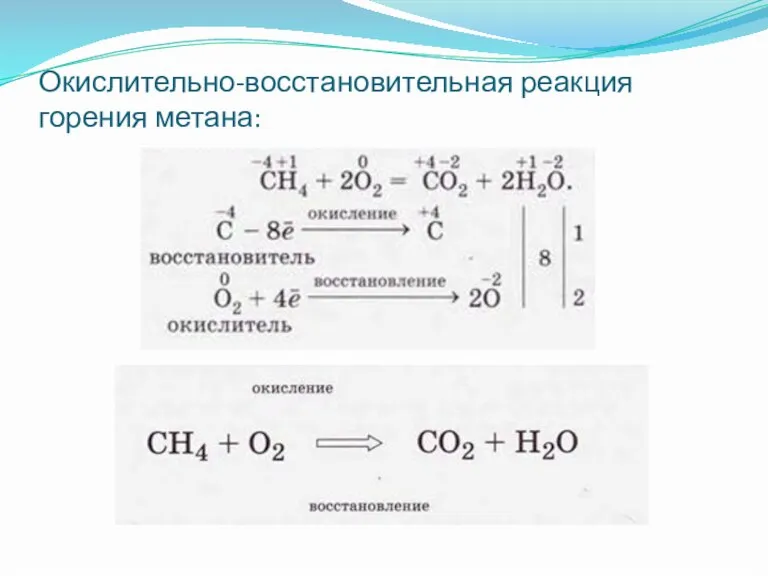
Слайд 6Окислительно-восстановительная реакция горения метана:
Слайд 8
Наиболее сильными восстановителями являются металлы, водород, оксид углерода (II), углерод, сероводород, аммиак

и др.
Наиболее сильными окислителями являются фтор, кислород, озон, галогены, азотная и серная кислоты, перманганат калия и др.
Однако самым сильным из известных окислителей и восстановителей является электрический ток. Он восстанавливает даже щелочные и щелочноземельные металлы и алюминий из их соединений и окисляет даже ионы галогенов и кислорода из их соединений до простых веществ.
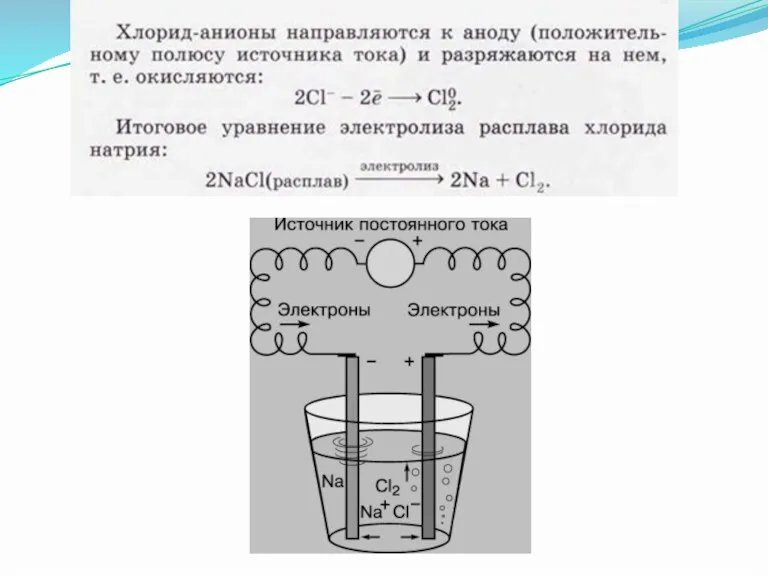
Слайд 9Электролиз
Электролизом называют окислительно-восстановительные реакции, протекающие на электродах при прохождении электрического тока

через расплав или раствор электролита.
Слайд 12Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности

и правила.
Слайд 16В промышленности электролиз находит широкое применение:
для получения щелочных, щелочноземельных металлов и алюминия;
для

получения галогенов, водорода и кислорода;
для нанесения металлических покрытий на поверхность изделий — никелирование, хромирование, золочение (общее название таких процессов — гальваностегия);
для изготовления рельефных металлических копий (гальванопластика);
для очистки цветных металлов от примесей (рафинирование).














 Сибирский ответ боли в суставах! от Siberian Wellness
Сибирский ответ боли в суставах! от Siberian Wellness Сведения и классификация системы управления строительных машин. Конструкция механической системы управления
Сведения и классификация системы управления строительных машин. Конструкция механической системы управления Соусы, полуфабрикаты
Соусы, полуфабрикаты Устный счет
Устный счет Я и мобильный телефон
Я и мобильный телефон Научно-исследовательская лаборатория АНО ДПО Уральского Ювелирного Центра
Научно-исследовательская лаборатория АНО ДПО Уральского Ювелирного Центра Города в пустыне Изобразительное искусство 4 класс
Города в пустыне Изобразительное искусство 4 класс  Курс “черчение”
Курс “черчение” Презентация на тему Абрам Федорович Иоффе — создатель отечественной физической школы
Презентация на тему Абрам Федорович Иоффе — создатель отечественной физической школы  Основы селекции. Работы Н.И. Вавилова
Основы селекции. Работы Н.И. Вавилова Презентация на тему Систематика типа хордовые (Хордовые)
Презентация на тему Систематика типа хордовые (Хордовые) Презентация на тему Инерция
Презентация на тему Инерция Самые распространенные темы конфликтов
Самые распространенные темы конфликтов Природа чудит
Природа чудит Кандидат на пост председателя Городского Совета молодежи
Кандидат на пост председателя Городского Совета молодежи Барокко
Барокко Как отпугнуть ИТ специалистов? Взгляд разработчика
Как отпугнуть ИТ специалистов? Взгляд разработчика Дамир Халилов Агентство интернет-PR «Green»
Дамир Халилов Агентство интернет-PR «Green» Отчет по производственной практике
Отчет по производственной практике Реклама для ВУЗа. Цель согласована с планом реализации и не противоречит другим задачам
Реклама для ВУЗа. Цель согласована с планом реализации и не противоречит другим задачам Математический бой
Математический бой План курса. Управление активами ИБ и уязвимостями прикладного и общесистемного ПО
План курса. Управление активами ИБ и уязвимостями прикладного и общесистемного ПО Арктика
Арктика Бельгия
Бельгия Лекторская группа СШ№11 г. Костаная
Лекторская группа СШ№11 г. Костаная Палехская сюжетная роспись
Палехская сюжетная роспись ПАТОФІЗІОЛОГІЯ БІЛКОВОГО ОБМІНУ
ПАТОФІЗІОЛОГІЯ БІЛКОВОГО ОБМІНУ Кулинарный шедевр в подарок
Кулинарный шедевр в подарок